











- Locations
- Deutschland
- Blogs
- Das Delta-Dossier: Entscheidender Baustein für den nationalen Market Access
Der Begriff "Delta-Dossier" hat sich mittlerweile für Wirkstoff-Dossiers, die dem EU-HTA (EU-weites Health Technology Assessment) unterliegen, verstetigt.1 Der Begriff erweckt allerdings einen falschen Eindruck davon, wie sich die Einführung des EU-HTA auf den nationalen Dossier- und damit Strategieprozess für einen Market Access auswirkt. Der Zusatz Delta suggeriert, dass es nur darum ginge Lücken zu füllen, die im EU-HTA-Dossier offengelassen werden. Damit wird nahegelegt, dass in Zukunft eigentlich das EU-Dossier die Hauptrolle im nationalen HTA spielen wird .
EU-Dossier ersetzt das Delta-Dossier eben nicht
Es ist aber gerade umgekehrt: Während absehbar ist, dass das EU-Dossier eine wichtige Rolle im nationalen HTA-Prozess spielen wird, ist für die nationale Organisation der Pharmaunternehmen das nationale Delta-Dossier der zentrale Baustein ihrer Market-Access-Strategie. HTA-Behörden haben nämlich wenig Interesse daran, von ihren nationalen Anforderungen abzuweichen und beziehen sich bei ihrer Prüfung, ob die nationalen Anforderungen eingehalten werden, vor allem auf das nationale Dossier. Ebenso ist es auch das nationale Dossier, das den Hintergrund für die Preisverhandlung mit den Krankenkassen darstellt.
Nationale und internationale Anforderungen
Es ist aber gerade umgekehrt: Während absehbar ist, dass das EU-Dossier eine wichtige Rolle im nationalen HTA-Prozess spielen wird, ist für die nationale Organisation der Pharmaunternehmen das nationale Delta-Dossier der zentrale Baustein ihrer Market-Access-Strategie. HTA-Behörden haben nämlich wenig Interesse daran, von ihren nationalen Anforderungen abzuweichen und beziehen sich bei ihrer Prüfung, ob die nationalen Anforderungen eingehalten werden, vor allem auf das nationale Dossier. Ebenso ist es auch das nationale Dossier, das den Hintergrund für die Preisverhandlung mit den Krankenkassen darstellt.
Herausforderungen durch das EU-HTA
Weil dem Delta-Dossier eine solch zentrale Bedeutung zukommt, sollte sich keine nationale Pharma-Organisation darauf verlassen, lediglich Lücken des EU-Dossiers füllen zu müssen – zumal durch den neuen EU-HTA-Prozess neue Herausforderungen entstehen: Die gegebenenfalls unabhängig von der nationalen (Delta-)Strategie entwickelte, international ausgerichtete EU-HTA-Strategie muss im Umkehrschluss auch wieder national aufgegriffen werden (vgl. Abb.).
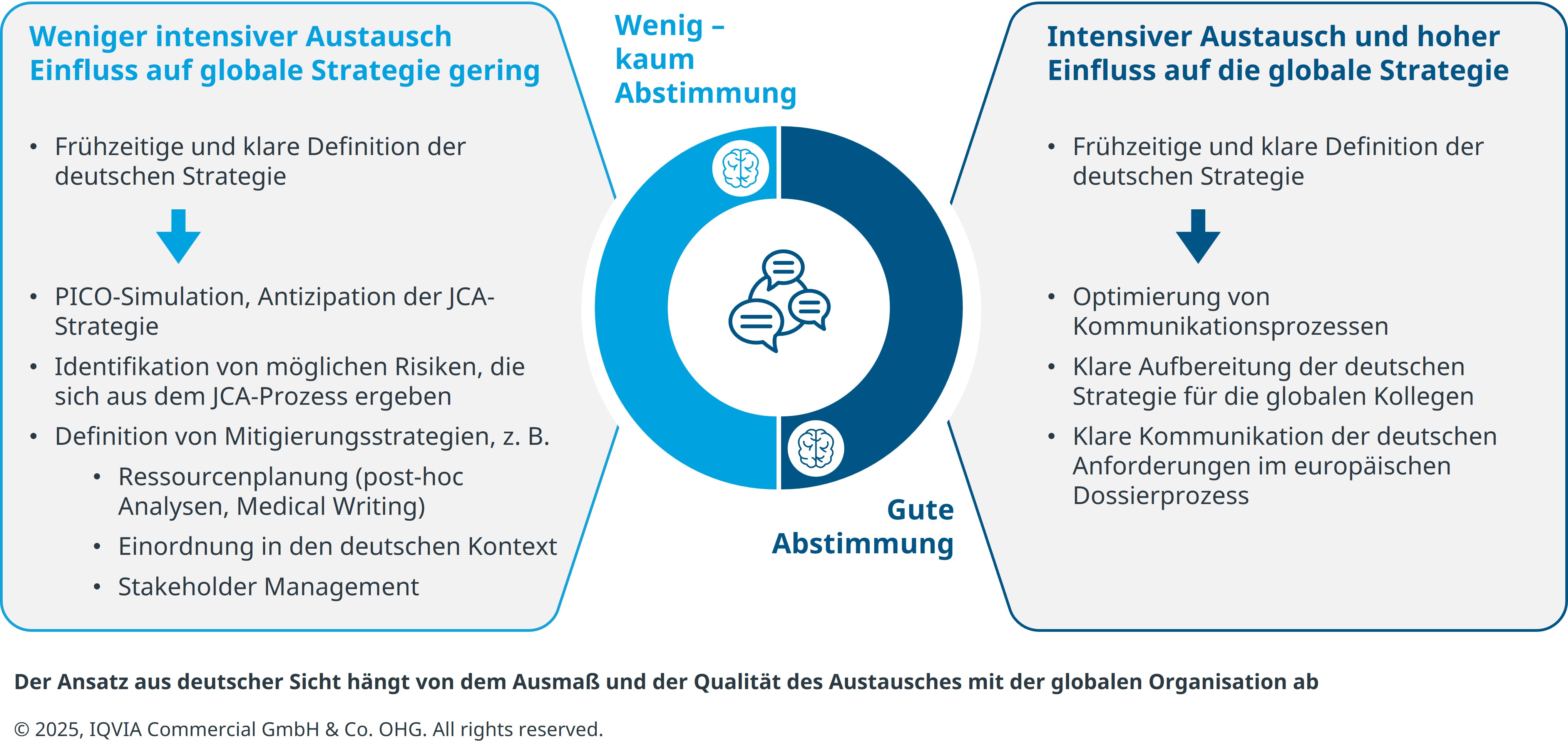
Strategische Entscheidungen auf europäischer oder globaler Ebene haben deshalb größere Auswirkungen auf nationaler Ebene als vorher. Punkte wie:
- die Positionierung des Produktes, bspw. die Relevanz bestimmter Teilpopulationen,
- die Diskussion zum therapeutischen Bedarf und wie er durch das Produkt gedeckt wird und
- die Darstellung der geeigneten zweckmäßigen Vergleichstherapie
sind hier angesprochen.
Alltagsrealität
In vielen Fällen wird die Market-Access-Strategie auf nationaler Ebene nicht eindeutig dem globalen Vorgehen entsprechen können. So sind möglicherweise bestimmte Teilpopulationen auf nationaler Ebene weniger relevant, oder vielleicht ist die zweckmäßige Vergleichstherapie nicht eindeutig und es gibt offene Diskussionspunkte hinsichtlich der Versorgungsrealität oder der Relevanz von klinischen Endpunkten. Auch können die Anforderungen des nationalen HTA eine kurzfristige Darstellung vollständiger Studiendaten erforderlich machen, obwohl genau dies eigentlich durch das EU-HTA vermieden werden sollte. In all diesen Fällen sind insbesondere die späteren Datenschnitte von Relevanz2.
Die Art, wie diese Herausforderungen adressiert werden, hängt stark von den internen Strukturen des Unternehmens ab.
Besonders wichtig ist ein früher und sehr intensiver Austausch zwischen nationalen und globalen Teams. In der Realität ist die Interaktion zwischen den nationalen und globalen Organisationsebenen aber ein Kontinuum zwischen schwacher und starker Integration der nationalen Organisationen in globale Entscheidungen. Deshalb erfolgt in manchen Fällen die Entwicklung des EU-Dossiers noch komplett unabhängig von den nationalen Teams, und die nationalen Teams müssen infolge aktiv Sorge tragen, an die notwendigen Informationen zu kommen. In anderen Fällen ist die Einbindung der nationalen Teams sehr stark und sie haben großen Einfluss auf die Strategieentwicklung, was die strategische Abstimmung deutlich fördert, wenn man die Alternativszenarien durchdenkt.
Szenario 1:
Strategie so entwerfen, als gäbe es kein EU-HTA
Bei einer starken Integration von nationalen Teams besteht die Möglichkeit, dass sie die Strategie des EU-HTA-Dossiers intensiv mitprägen. Zu bedenken ist hier wiederum, dass ein strukturierter Austausch erforderlich ist. Dieser könnte im Vorfeld in sogenannten „Playbooks“ festgelegt werden und es empfiehlt sich weiterhin, ein regelmäßiges Touch-Point-System zu definierten Meilensteinen einzuführen. Vor allem aber muss die nationale Strategie sehr sorgfältig vorbereitet werden, um die nationalen Erfordernisse klar an das internationale EU-HTA-Team kommunizieren zu können. Dabei gilt: Entwerfe die Strategie so, als gäbe es kein EU-Dossier und überlege im nächsten Schritt eine geeignete Kommunikationsstrategie für die Umsetzung im EU-HTA-Kontext.
Szenario 2:
Strategie so entwerfen, als gäbe es kein EU-HTA
Ist der Austausch „national <=> global“ weniger intensiv und erfolgt er relativ spät im Prozess, muss das nationale Team mögliche Risiken, die durch das EU-Dossier entstehen, antizipieren und Mitigierungsstrategien entwickeln. Initial ist das Vorgehen dabei identisch zu Szenario 1: Es gilt eine nationale Strategie zu entwickeln, als ob es kein EU-Dossier gäbe. Zusätzlich muss dann die EU-Strategie antizipiert und mögliche Risiken identifiziert werden. Hierzu zählt das Fehlen von Informationen im EU-Dossier, aber auch eine mangelnde Reflexion des deutschen Versorgungskontextes.
Für genau diese Risiken müssen vorab Mitigierungsstrategien für das deutsche Delta-Dossier entwickelt werden. Das kann bedeuten, dass man Dossier-Kapitel ohne Verweis auf das EU-Dossier ausfüllt oder zumindest Ergänzungen vornimmt, dass man zusätzliche Daten darstellt oder dass mit Bezug auf das JCA-Dossier eine angepasste Stakeholder-Kommunikation entwickelt wird.
Schlussfolgerung
Die Einführung des EU- Dossiers bedeutet keine verminderte Relevanz des nationalen Dossiers, sondern lediglich, dass genau dieses Delta-Dossier nicht mehr in Isolation betrachtet und erstellt werden kann.
Das Aufgreifen von Inhalten aus dem EU-Dossier verzahnt nationale und globale Entscheidungsebenen enger und sorgt für die Notwendigkeit, interne Stakeholder noch stärker einzubinden. Insbesondere muss das globale EU-HTA-Team für die nationalen Belange des Market-Access sensibilisiert werden und nationale Market-Access-Strategien gilt es früher als bisher zu entwerfen.

Im Idealfall ergeben dann das Delta-Dossier und das EU-HTA-Dossier eine Gesamtdarstellung der Evidenz eines Produktes und Wirkstoffes, die die nationalen Teams bei ihrer Kernaufgabe – nämlich das Produkt erfolgreich zu vermarkten – bestmöglich unterstützt.
1 Das EU-HTA ist eine seit Januar 2025 gültige, EU-weite Verordnung zur Harmonisierung der klinischen Wirkstoffnutzenbewertung der EU-Länder. Sie wurde erlassen, um Doppelarbeit der Länder zu vermeiden. Da der Wirkstoff jedoch in ländertypische Arzneimittelversorgungsstrukturen eintritt, gilt es im nationalen Zulassungsprocedere und speziell im AMNOG-Verfahren Deutschlands, zusätzliche, nationale Informationen darzulegen. Dieser landesspezifische Content wird im Delta-Dossier niedergeschrieben.
2 Auswertung der Studiendaten zu einem a priori festgelegten Zeitpunkt, z. B. bei Erreichen einer bestimmten Zahl von Ereignissen.
Bei Fragen melden Sie sich gerne bei uns
Autoren:
 |
Dr. Johannes Klaus Engagement Manager Real World Solution (RWS), Market Access HTA, IQVIA |
 |
Dr. Penelope Gallinger Principal Consulting Services, Consulting, IQVIA |





