- Insights
- The IQVIA Institute
- Reports and Publications
- Reports
- Global Oncology Trends 2019
Institute Reportは、米国のIQVIA Institute for Human Data Scienceが発表する刊行物です。 本文や解説全ての正式言語は英語であり、その内容および解釈については英文が優先します。原文の英語版はこちら https://www.iqvia.com/en/institute/reports/global-oncology-trends-2019
レポートについて
近年、記録的な数の新しいオンコロジー領域の医薬品が承認され、新たな治療オプションを患者にもたらしていますが、活発なパイプラインにもかかわらず、オンコロジーは研究開発にとって難題な領域です。このレポートでは、オンコロジー領域のパイプラインの生産性とアウトプット、新しい作用機序、そして新たな治療の恩恵に預かる可能性のある患者について調査しています。本調査では世界的なオンコロジー領域の医薬品の支出、臨床試験活動、複雑さと成功、そして2023年までの展望に焦点を当てました。レポートでは、免疫療法、次世代バイオ医薬品およびバイオシミラーの参入による治療法の変化についても言及しています。
レポートの概要
2018年には、17の適応症に対し記録的な数である15の新たなオンコロジー領域の治療薬が上市されました。新しい治療法の半数以上が経口剤として提供され、希少疾患の適応症、もしくは予測バイオマーカーがその効能に含まれています。また最近導入された治療法は、様々な癌種に幅広く初期段階の治療で使用されてもいます。米国では2017年以降免疫療法の使用は倍増し、HER-2陰性乳癌に対する新規サイクリン依存性キナーゼ4/6阻害剤(新規CDK4/6阻害剤)による治療が米国と欧州で激増しています。
後期開発段階にある薬剤のパイプラインは2018年だけで19%、2013年以降で63%拡大しており、パイプライン内および臨床開発の全段階を通じ、60以上の作用機序を有する450種近い免疫療法に最も集中しています。細胞、遺伝子およびヌクレオチド療法として定義される、98の次世代バイオ医薬品もまた、臨床研究段階にあり、18の異なるアプローチを活用しています。
パイプラインが活発であるにもかかわらず、オンコロジー領域は研究開発にとって最も困難な薬効領域の1つであり、高い失敗リスクと長い開発期間に直面しています。次相移行の総合的成功率は、2017年の11.7%から2018年は8.0%へと減少し、オンコロジー領域の治験の期間は他の薬効と比較して依然長くなっています。過去5年間でオンコロジー領域の治験の第Ⅰ相試験の複雑さも上昇しています。オンコロジー領域の治験の試験に対する成功率で評価された全体的な生産性(複雑さと期間)は、2010年以降22%改善しましたが、他の薬効の試験と比べ依然はるかに低くなっています。
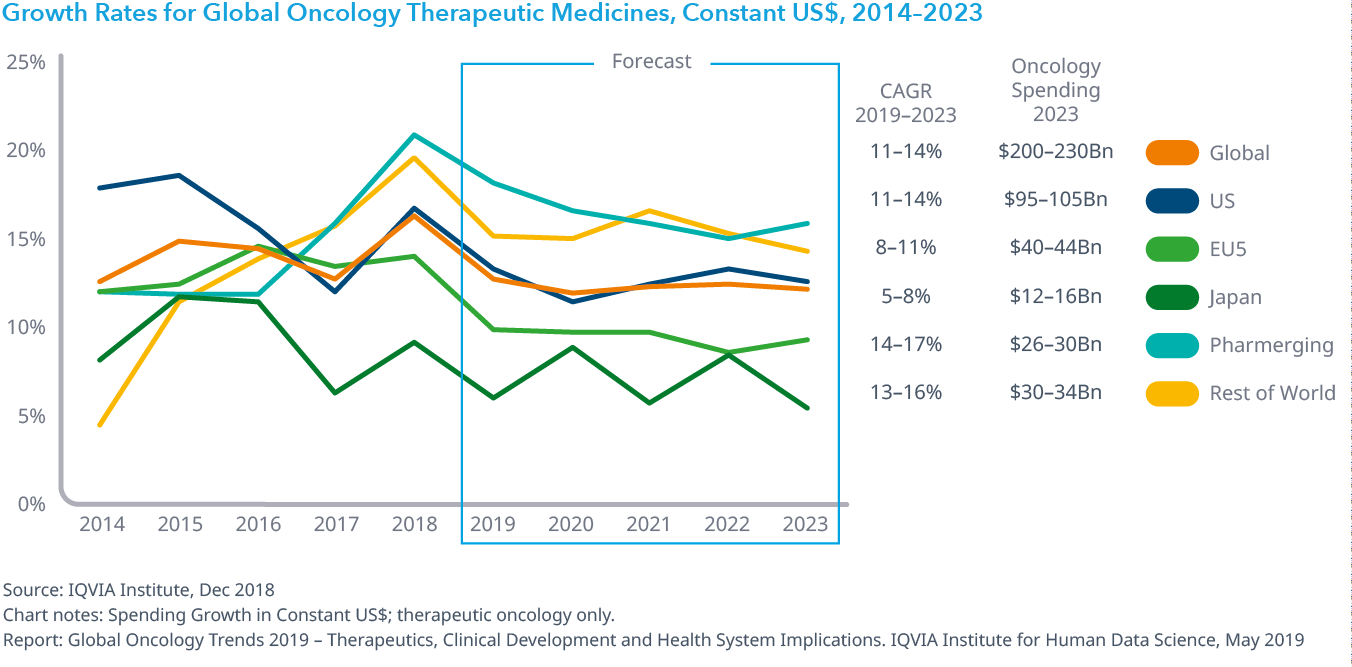
がん患者の治療に使用される全薬剤支出は、15.9%増加した治療薬に牽引され、2018年には12.9%増加して1,500億ドルに達し5年間連続で2桁成長を記録しました。中央値は2018年に13,000ドル下がって149,000ドルとなったものの、新薬の平均年間コストは上昇傾向にあり、製品当たりのコストは9万ドル~30万ドルの範囲にあります。中国は支持療法が10%減少したにもかかわらず、医薬品新興国市場の支出と成長を牽引し、2018年には24%増の90億ドルにまで成長しました。今後5年間で、治療費は年平均成長率ベースで11~14%増加すると予想され、市場全体は2,000~2,300億ドルにおよぶと予測されます。
主な知見
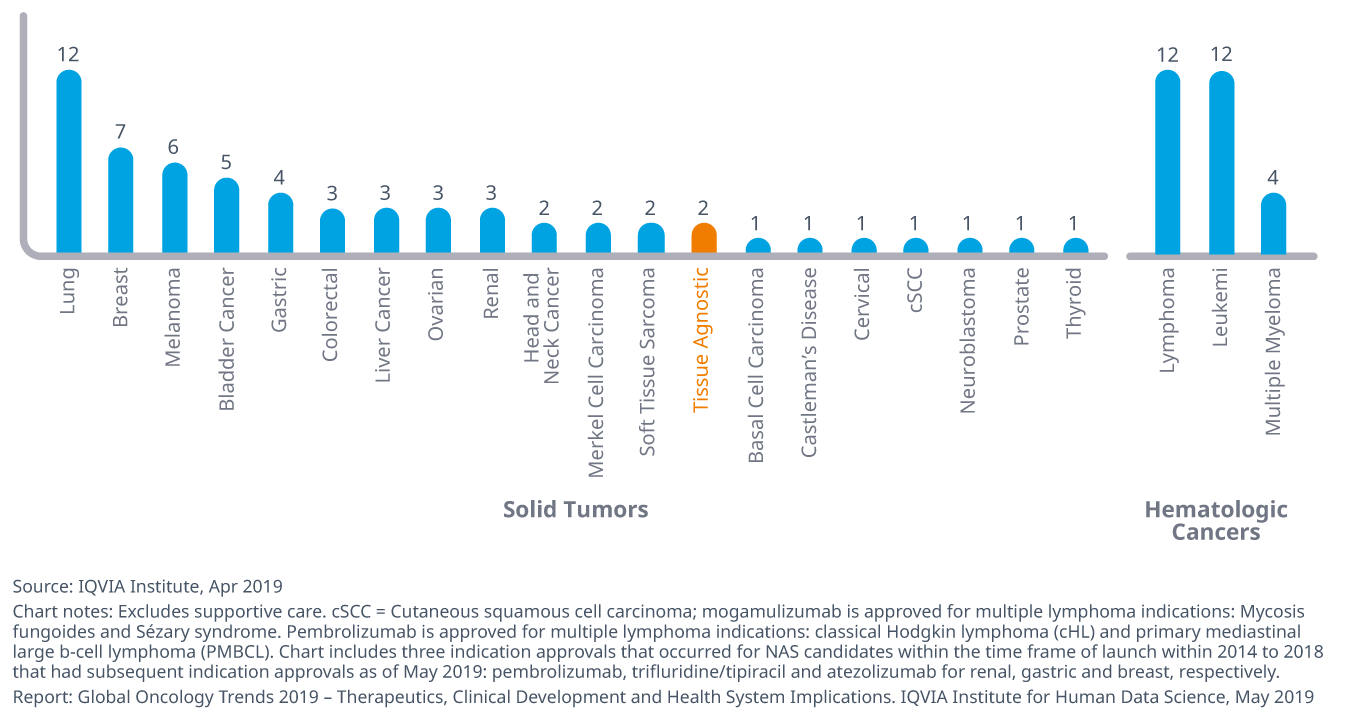
過去5年間で、新たに上市された57のオンコロジー領域の治療薬が89の適応症で承認され、複数癌種の治療に使われる薬剤もあります。
- 2018年には記録的な数の新しいオンコロジー領域の医薬品が上市され、患者に新たな治療オプションをもたらし、導入から5年もたたない免疫療法の導入から起こった治療パターンの変革が続きました。
- 過去5年間に承認された適応症のほぼ3分の1が血液癌でしたが、固形癌では肺がんが12適応症を取得して一番多く、それに乳癌や黒色腫が続きました。
- 2017年にパンドリズマブが初承認されたのに続き、2018年に二番目の組織非特異的オンコロジー領域の治療薬としてラロトレクチニブが承認されました。これは、オンコロジー領域において、体内の原発部位ではなく遺伝子プロファイルにもとづき腫瘍を治療するというパラダイムシフトが始まったことを反映しています。
2018年の後期段階オンコロジー領域のパイプラインには849成分が含まれており、標的治療薬の増加によって2008年から77%増加しました。
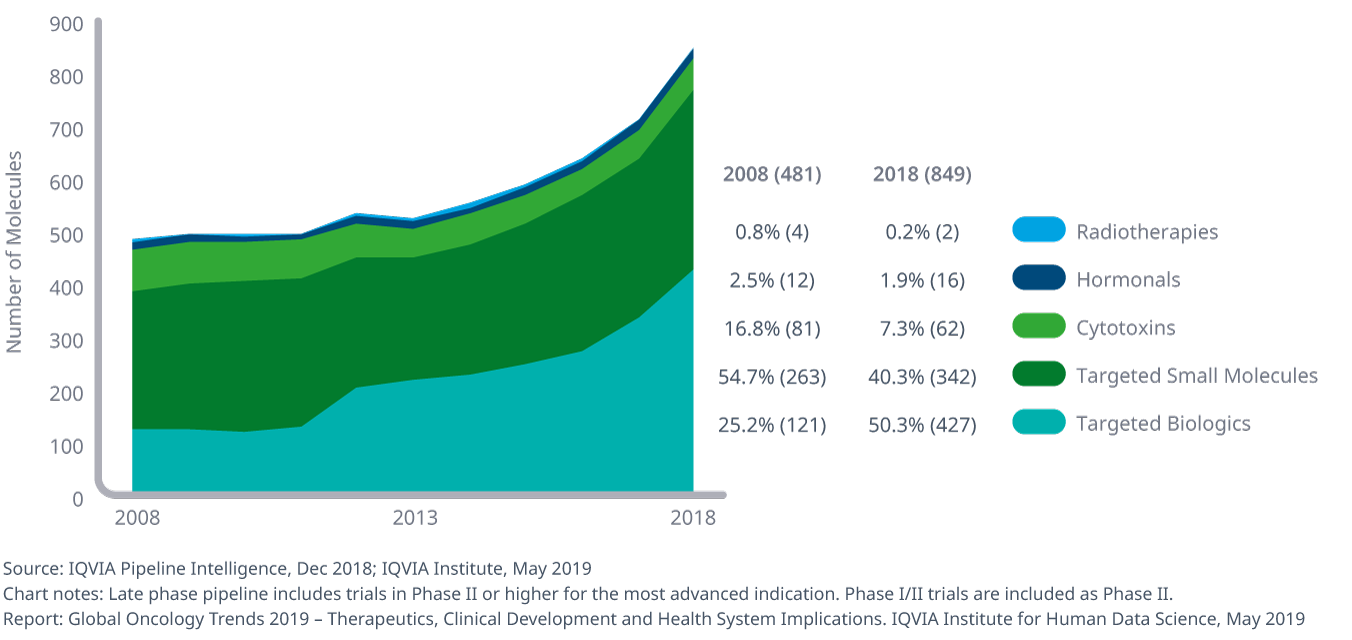
- 後期段階のパイプラインにある治療数は2017年の711例から2018年の849例へと19%大幅に増加しましたが、これはオンコロジー領域のパイプラインにおける標的療法の数が増加したためです。
- 2018年の後期段階にあるオンコロジー領域のパイプラインの91%は、細胞毒性薬のような非特異的療法ではなく低分子標的および生物学的療法でした。
- 作用機序の範囲拡大がとりわけ顕著ですが、関わる企業の数、および研究の進捗率の点で特に注目すべき薬剤がパイプラインに増えつつあります。
- 後期段階のオンコロジーの研究開発では、711社が積極的に計849の製品に取り組んでおり、その大半(88%)が新興バイオ医薬品企業によるものです。
約100種類の次世代バイオ療法が現在開発の後期段階にあります
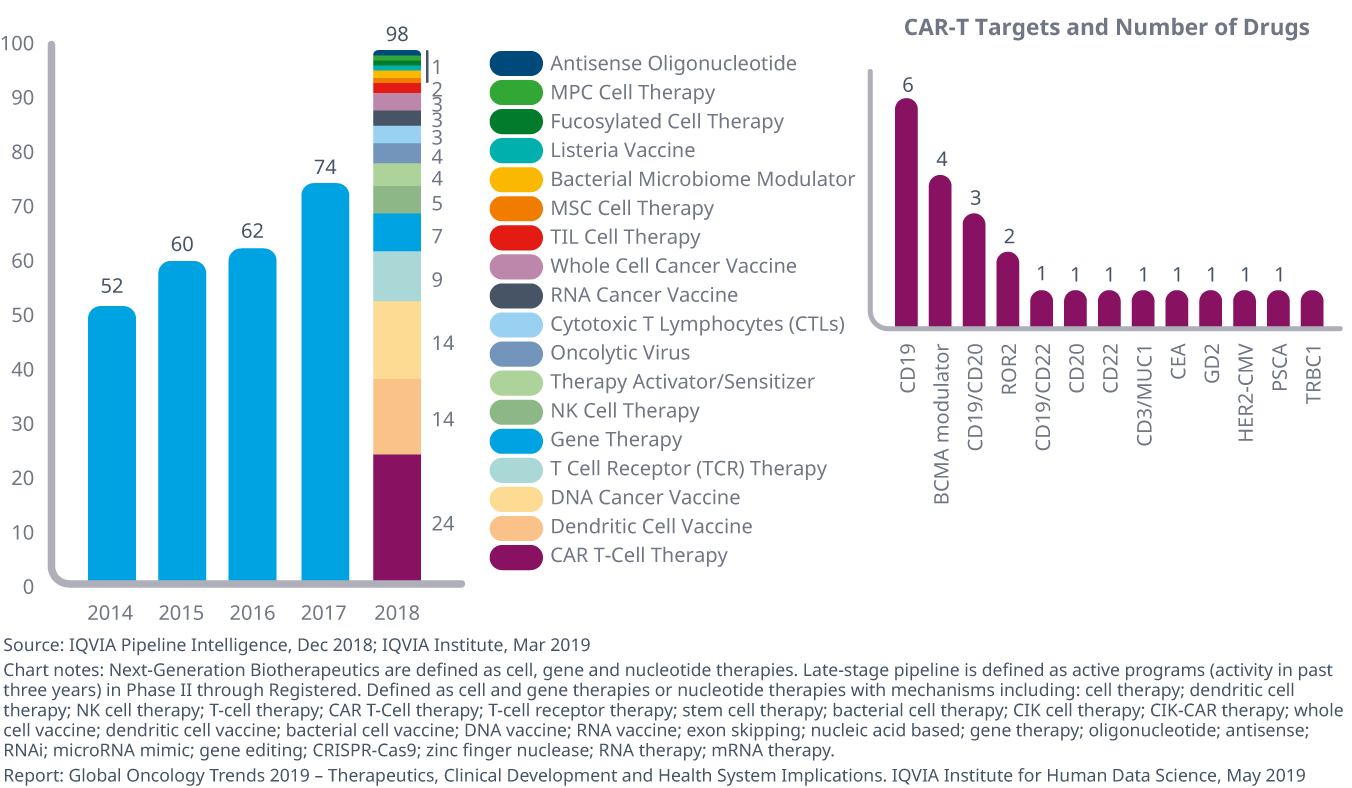
- オンコロジー領域の治療薬として開発されている次世代バイオ療法-細胞、遺伝子、およびヌクレオチド療法として定義される治療-は、疾患治療および治癒のための新たなアプローチとして2013年以降倍増、2017年から2018年までに32%増加し注目と投資が高まっています。
- 現在、450近いオンコロジー領域での免疫療法が開発の様々な段階にありますが、フェーズIIIおよび登録前パイプラインには9の作用機序が、初期パイプラインには62の作用機序が含まれています。
- PD1/PD-L1チェックポイント阻害剤は、依然として最も成功している免疫療法であり、剤型の改善(例:経口)、または標的療法 (例:チロシンキナーゼ阻害薬) との併用、または次世代バイオ療法との併用は、革新的治療薬につながる可能性もあります。
オンコロジー領域の治験は失敗のリスクが高く、2018年の総合的成功率は8%であり2010年以降の平均よりわずかに低い数値です。
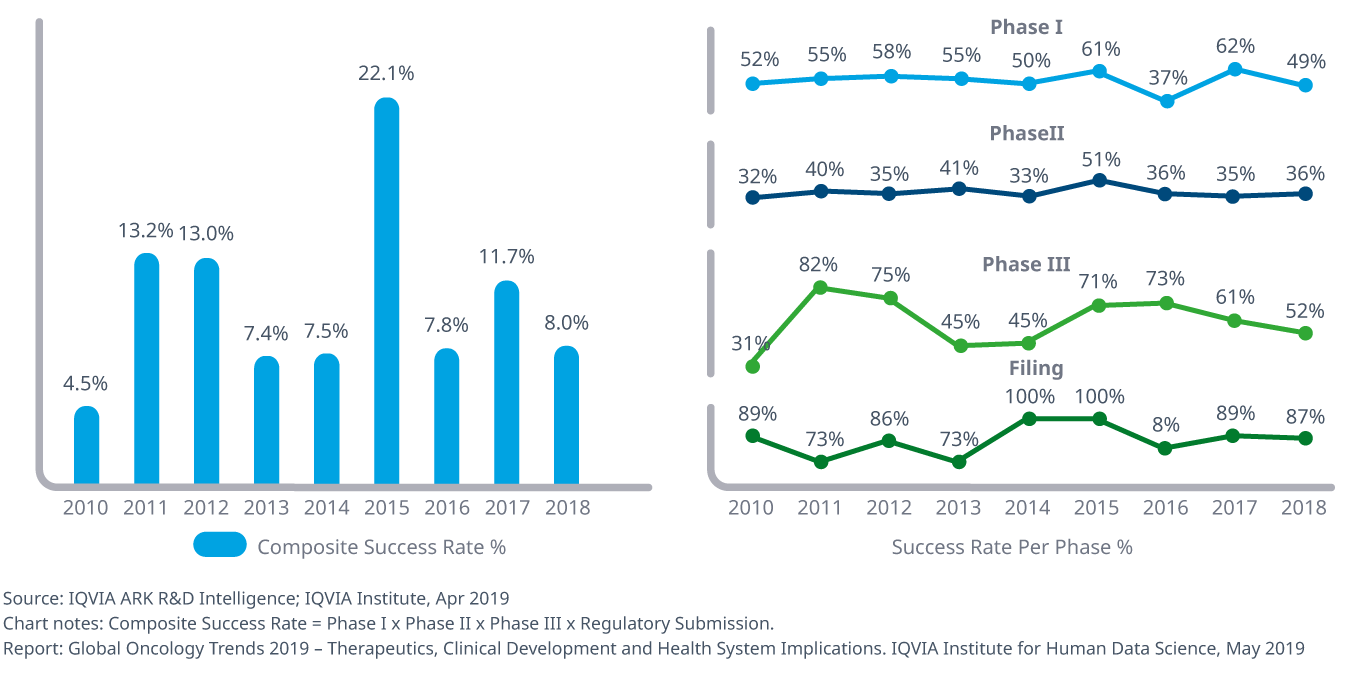
- フェーズIに入った製品が市場参入を果たす可能性で測定される総合的成功率は、オンコロジー領域の製品に関しては2015年と2017年は平均を上回っているものの、2013年以降ほぼ横ばいの7~8%の間で変動し、2010~2018年の総平均は10.6%でした。
- 2018年のオンコロジー領域の治験の平均期間は全試験期間を通じて3.2年で、他の薬効の1.8年と比較すると40%以上の差がありました。
- オンコロジー領域おける臨床試験の複雑さは、2014年から2018年にかけて11%、2010年から2018年にかけて22%増加しましたが、これはエンドポイントおよび参加者の適格基準の数が増加したためで、対象となる国および施設数の減少によって相殺されています。
現在の臨床開発動向が将来の生産性に及ぼす影響をモデル化すると、事前スクリーニングされた被験者プールやバイオマーカー検査の利用可能性によって、2023年までに前者で104%、後者で71%の生産性改善が可能であると思われます。
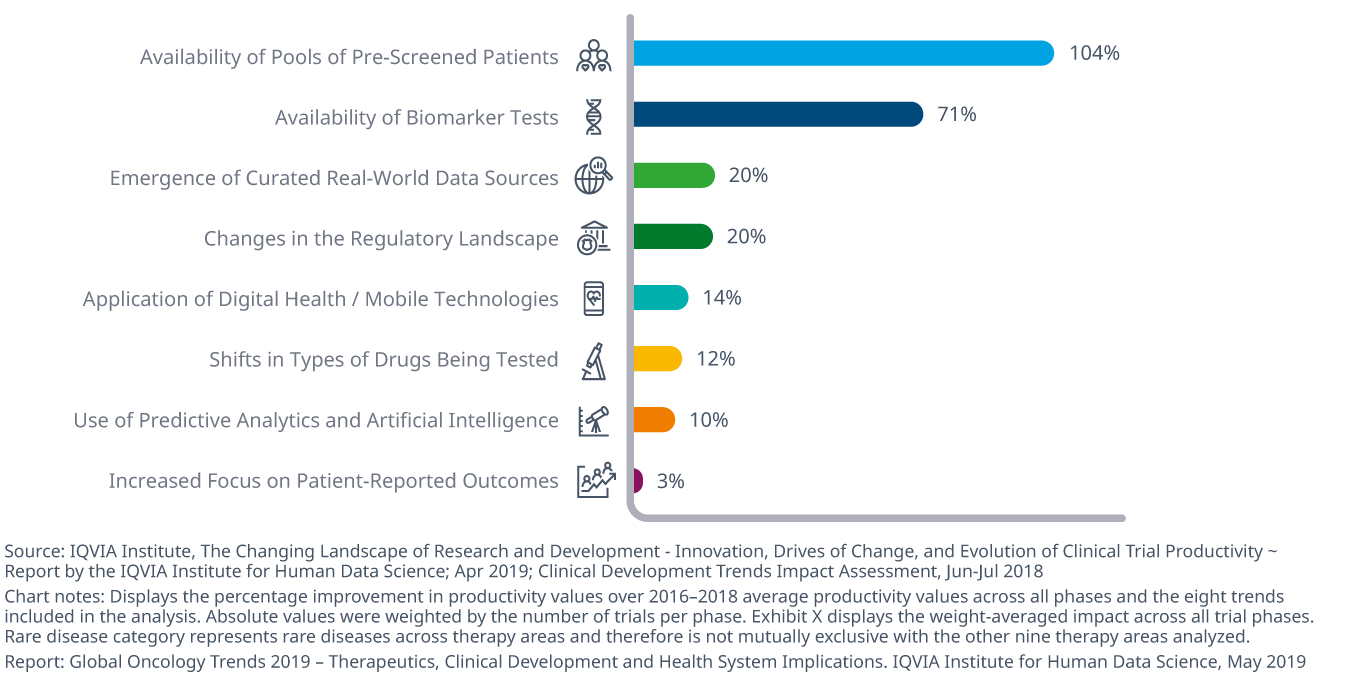
- オンコロジー領域の治験の全体的な生産性 (試験の複雑性と期間に対する成功率として測定) は2010年以降22%改善していますが、他の薬効領域の試験よりも依然としてはるかに低くなっています。
- オンコロジー領域の開発において最大の傾向は、試験参加への適格性評価や試験の迅速性や効率性を高めるといった目的で、事前スクリーニングされた患者の利用可能性だと予測されます。
- バイオマーカーは、創薬とその他の研究の両方の結果として引き続き発見されており、テストがより広範囲で利用可能になることで薬剤開発の全ての面を顕著に強化するでしょう。
オンコロジー領域における支出は2023年までに9~12%の成長し2400億ドル近くに達します。
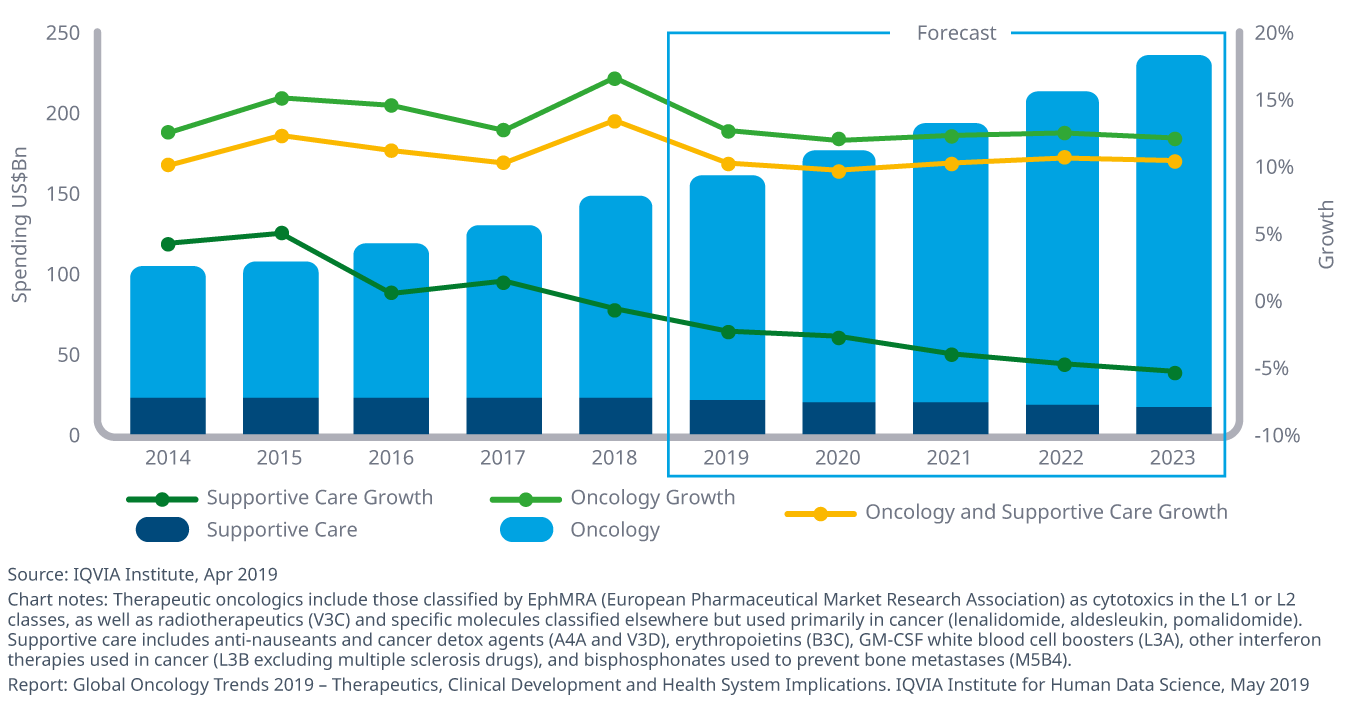
- がん患者の治療に使用される全薬剤の支出は、2018年には治療薬に牽引されて年間12.9%増の1,500億ドルに達し、一方支持療法薬への支出は2018年には1.5%減少しました。
- 中央値は2018年に13,000ドル下がって149,000ドルになりましたが、新しいオンコロジー領域の医薬品の平均年間コストは上昇傾向にあります。
- 中国のオンコロジー領域での支出は過去5年間で倍増しましたが、そのほとんどは既存のブランド薬の使用の増加によるもので、新規に上市された薬剤の支出は非常に少なく、また一人当たりの支出額は米国の173ドルに対し4.5ドルでした。
- 2023年までのオンコロジー領域の薬効への支出の伸び率は、米国、医薬品新興国とその他市場では二桁台、EU上位5カ国では一桁後半、日本では5-8%の高い伸びに達すると予測されています。
レポート中の図表
Chart 1: Oncologic New Actives Substances (NAS) Launched for the First Time in the United States in 2018
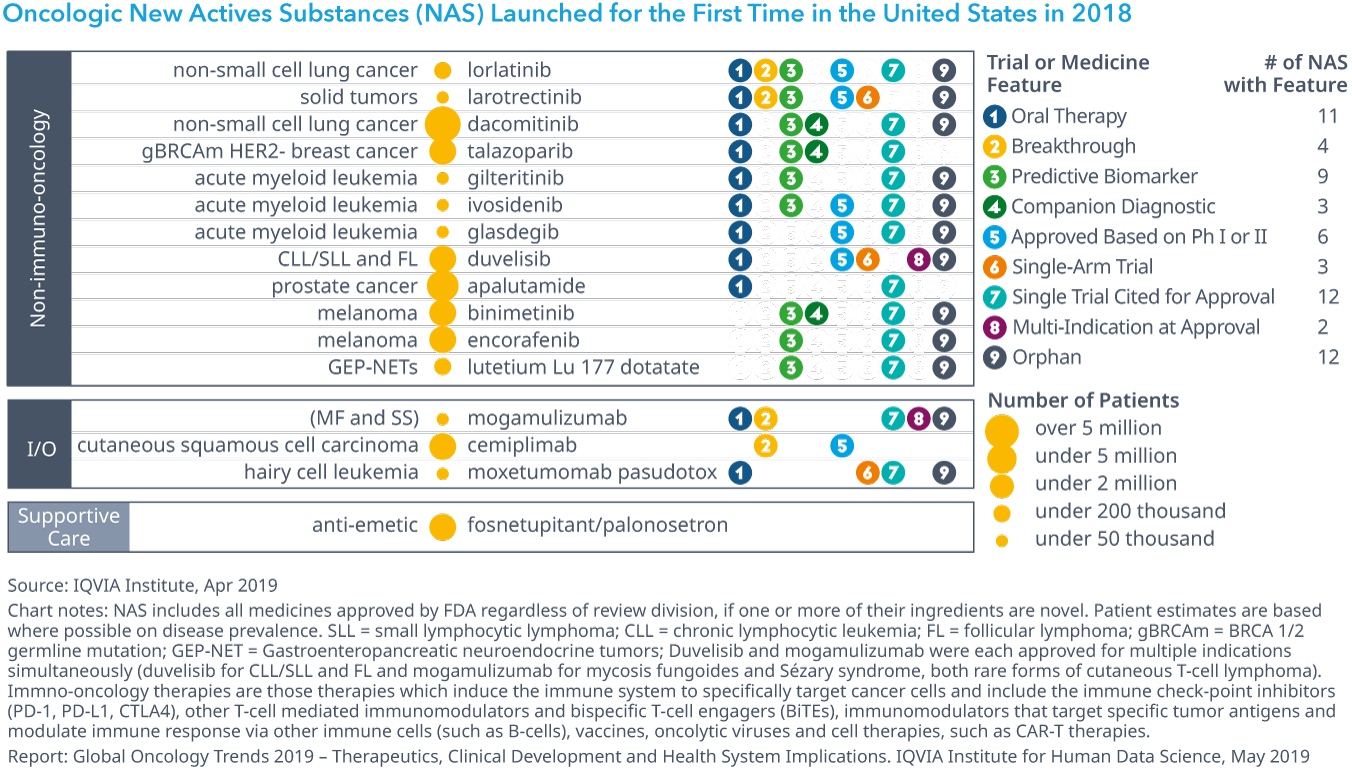
Chart 2: New Active Substances Launched in 2018 and Summary of Clinical Benefits
Chart 3: New Active Substance Approvals in Oncology by Tumor Type, 2014–2018
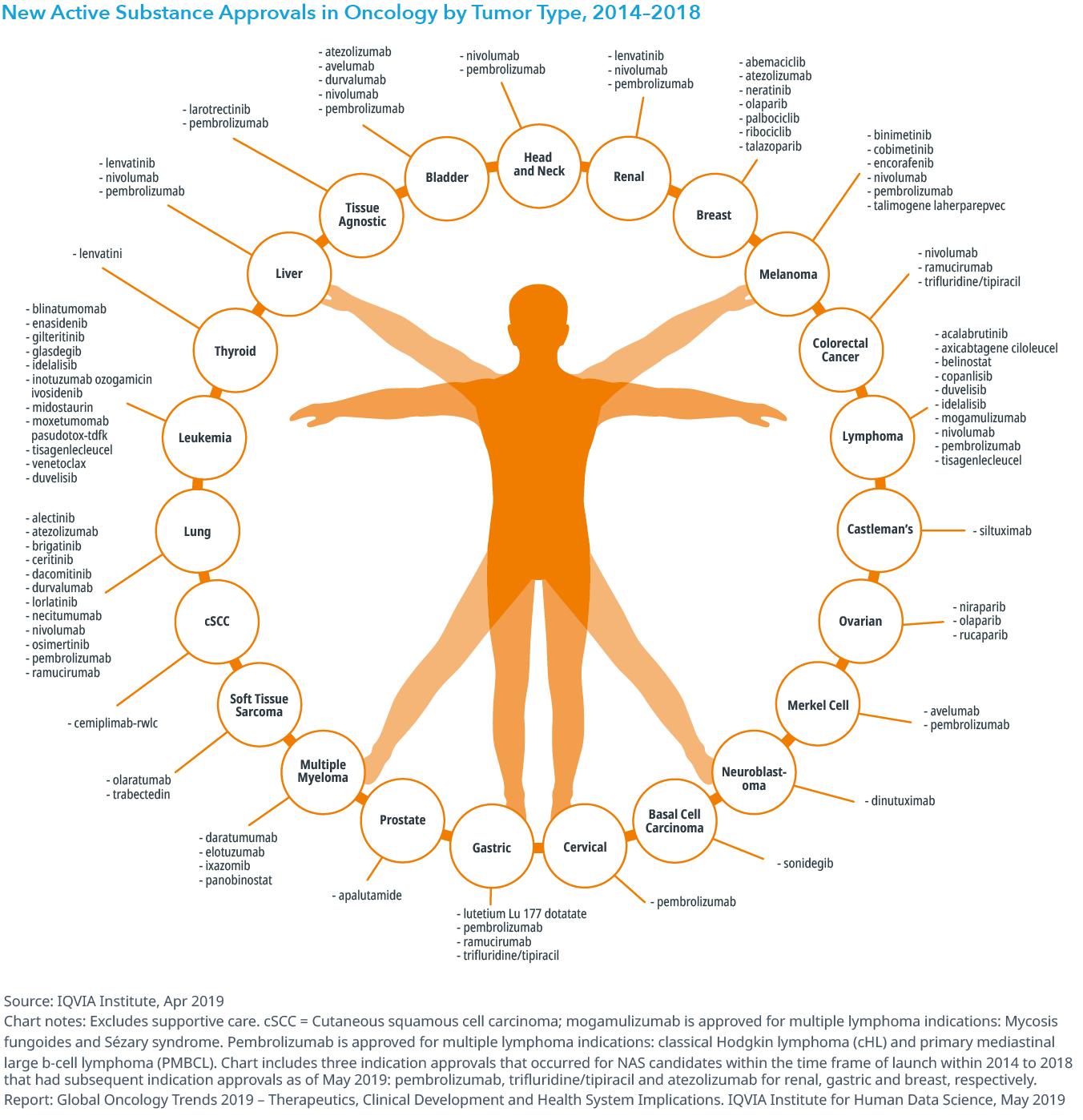
Chart 4: Number of New Active Substance Approvals in Oncology by Indication
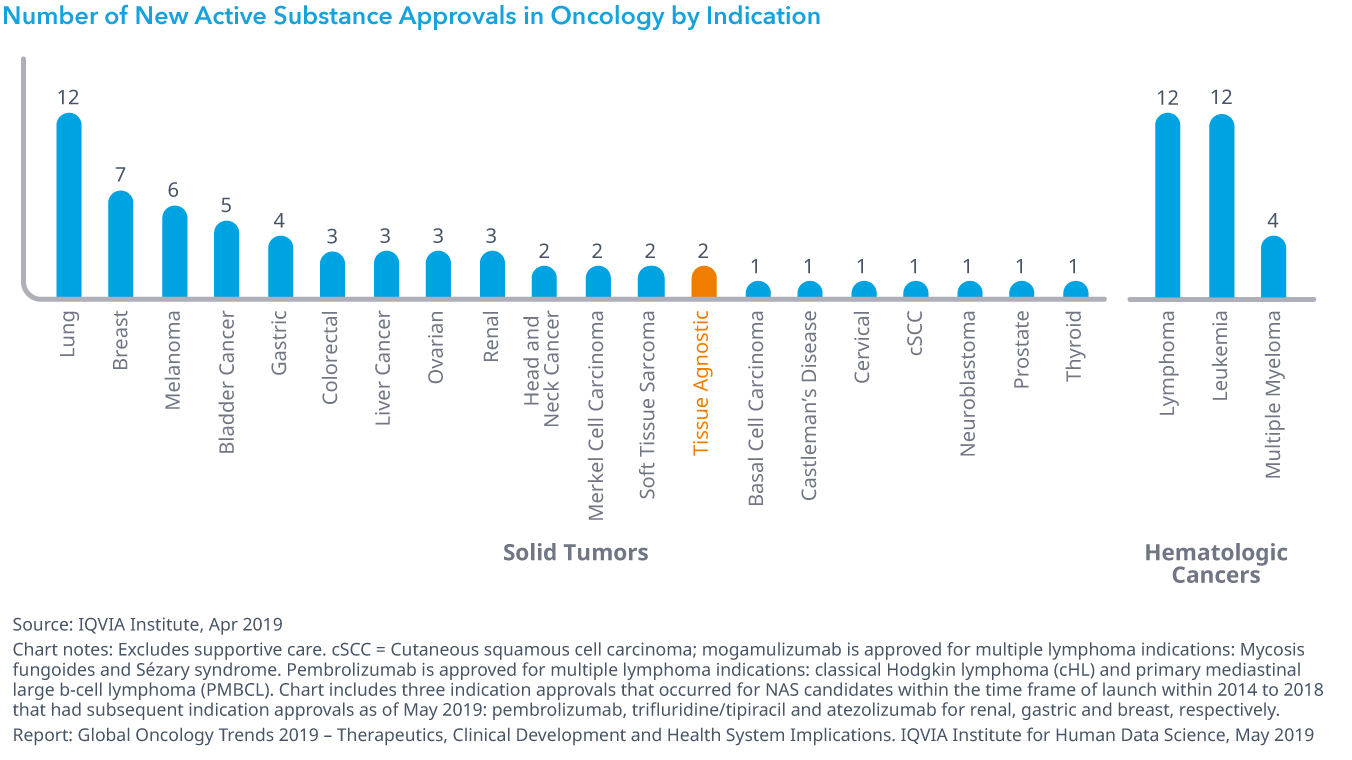
Chart 5: Select Positive and Negative Registration and Clinical Events in 2018
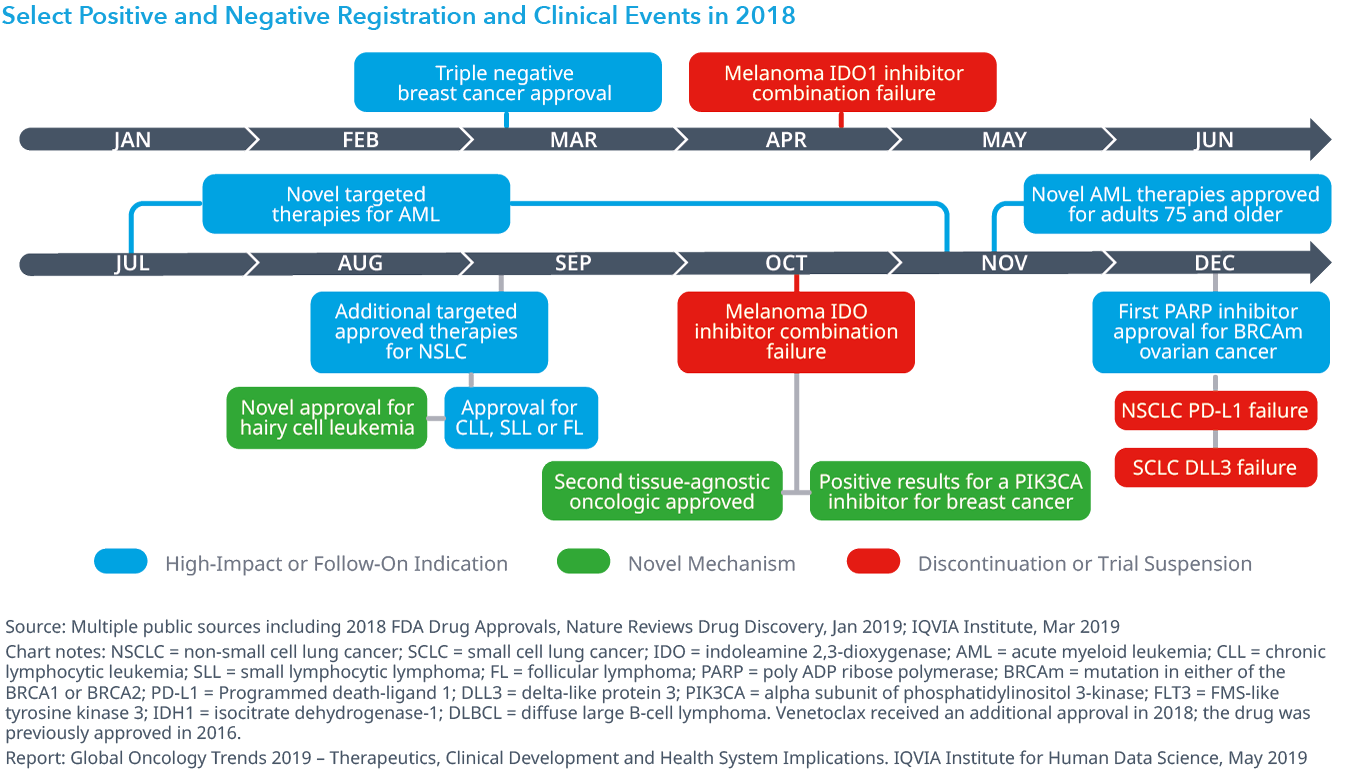
Chart 6: Unique Patients Treated with PD-1 and PD-L1, United States, 2014–2018
Chart 7: Share of Line of Therapy for Selected Tumors
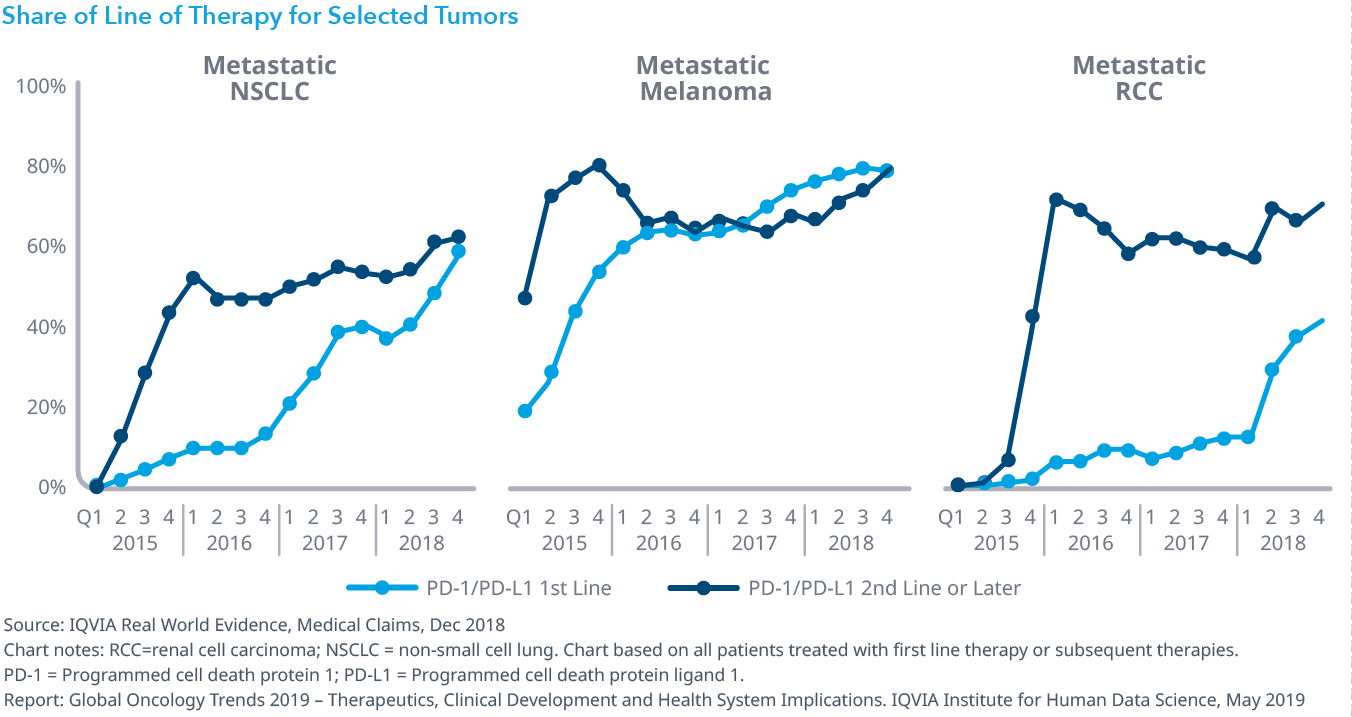
Chart 8: Metastatic Breast Cancer Patients Treated with Regimens Containing CDK 4/6 Agents in Thousands
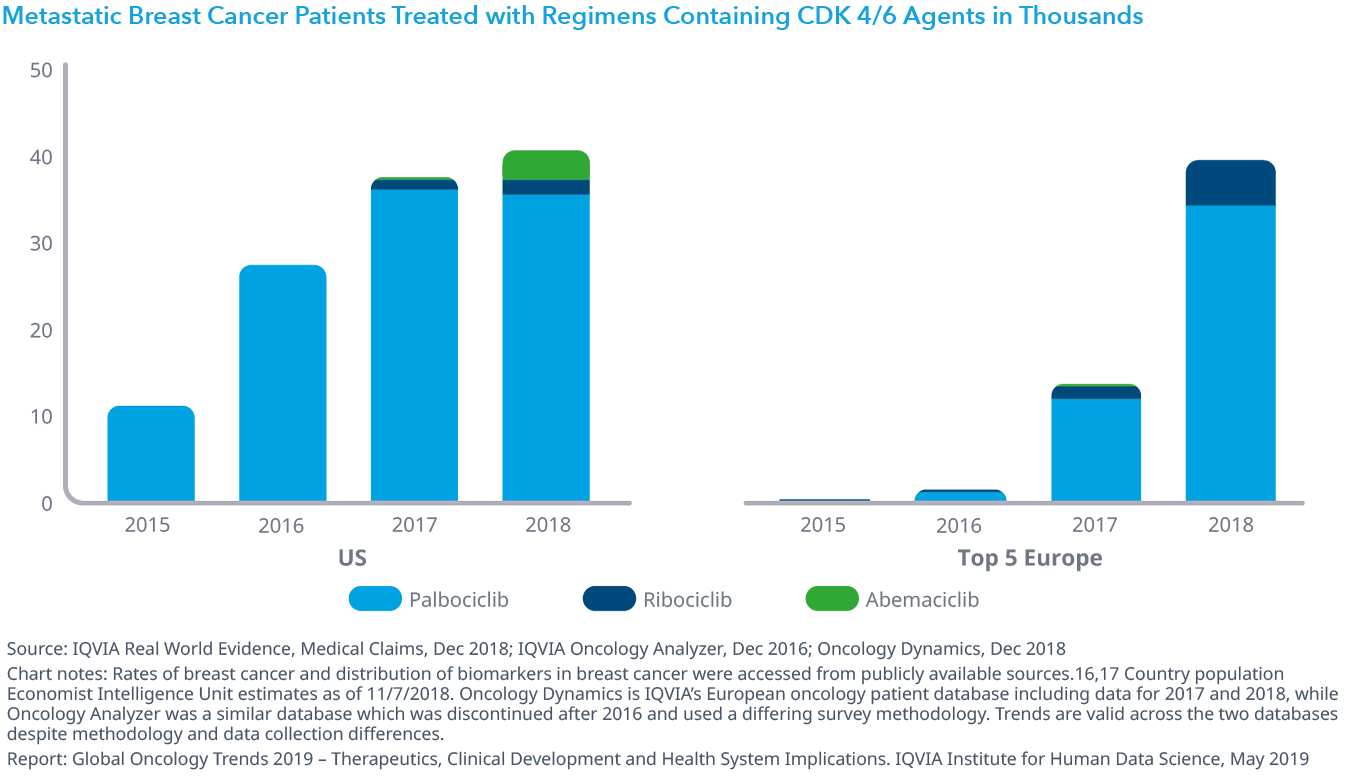
Chart 9: The Pipeline of Late Phase Oncology Molecules, 2008–2018
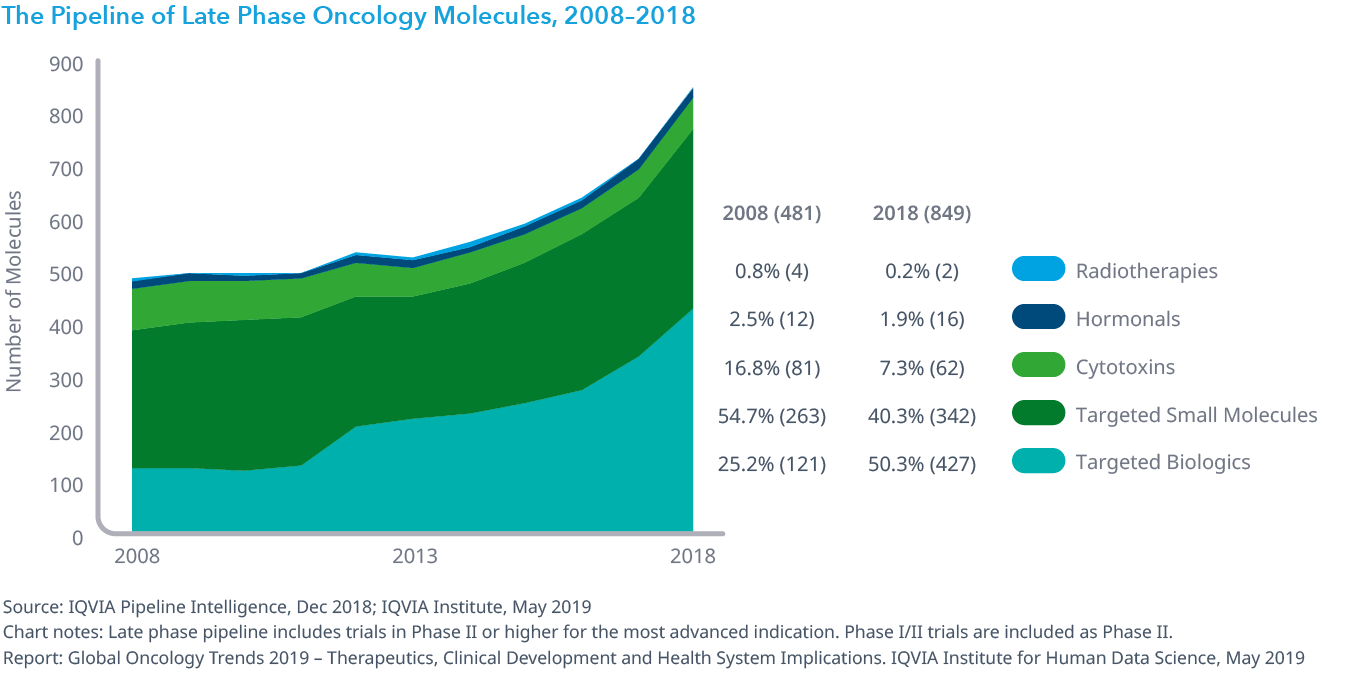
Chart 10: The Late-Stage and Early-Stage Immunotherapy Pipeline by Mechanisms of Action
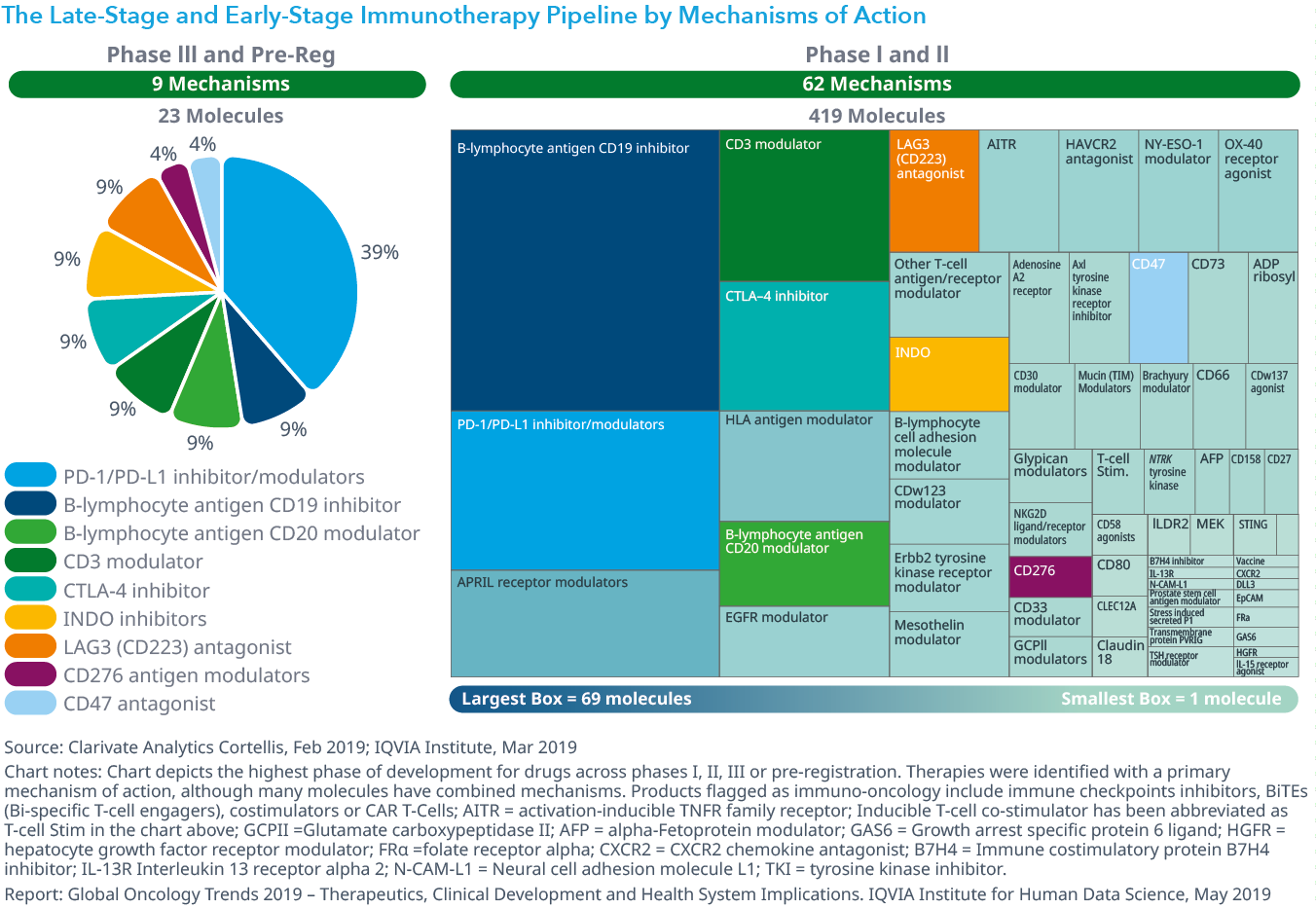
Chart 11: Number of Next-Generation Biotherapeutic Pipeline Products in Late-Stage Pipeline, 2014–2018
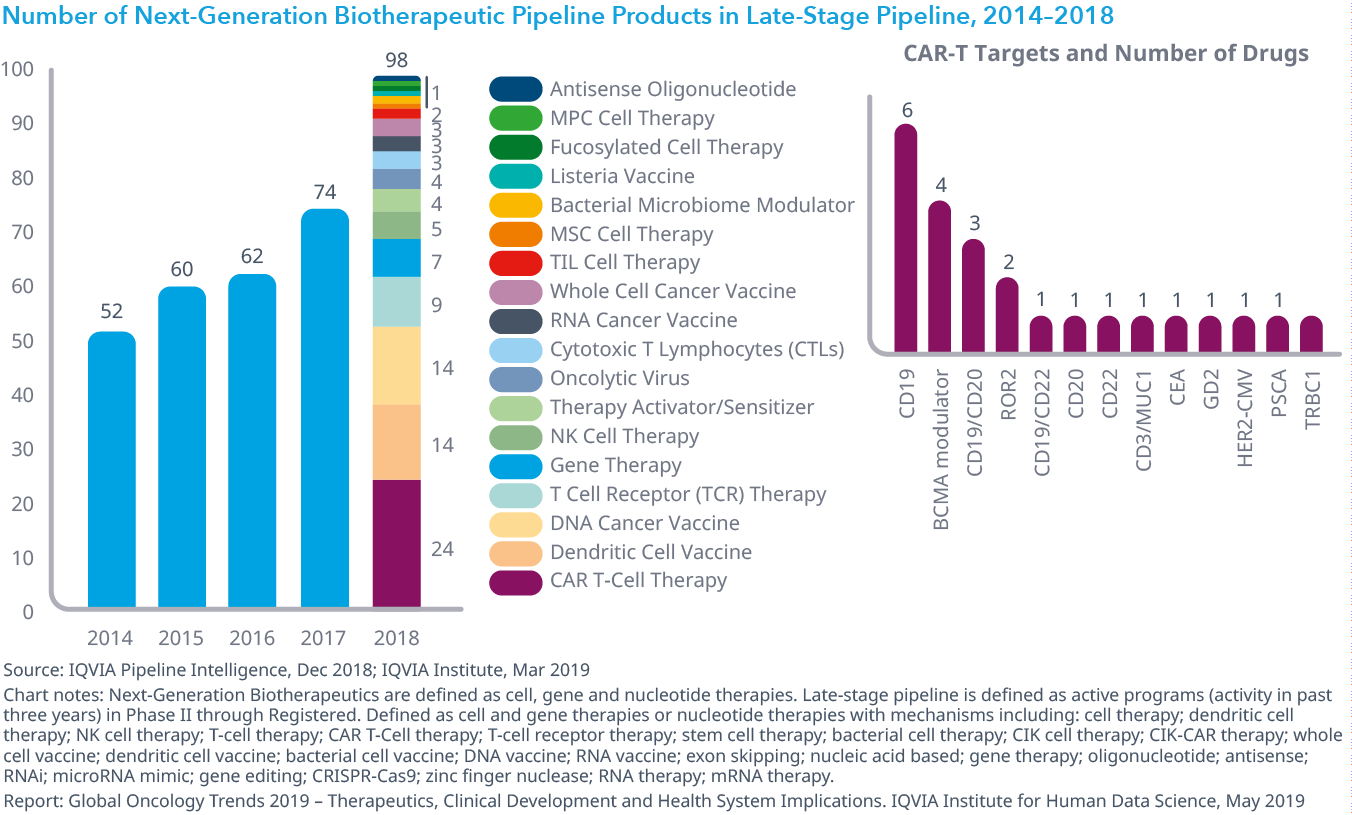
Chart 12: Top 25 Cancers and the Number of Mechanisms Targeting Each, Phase I Through Pre-Registration
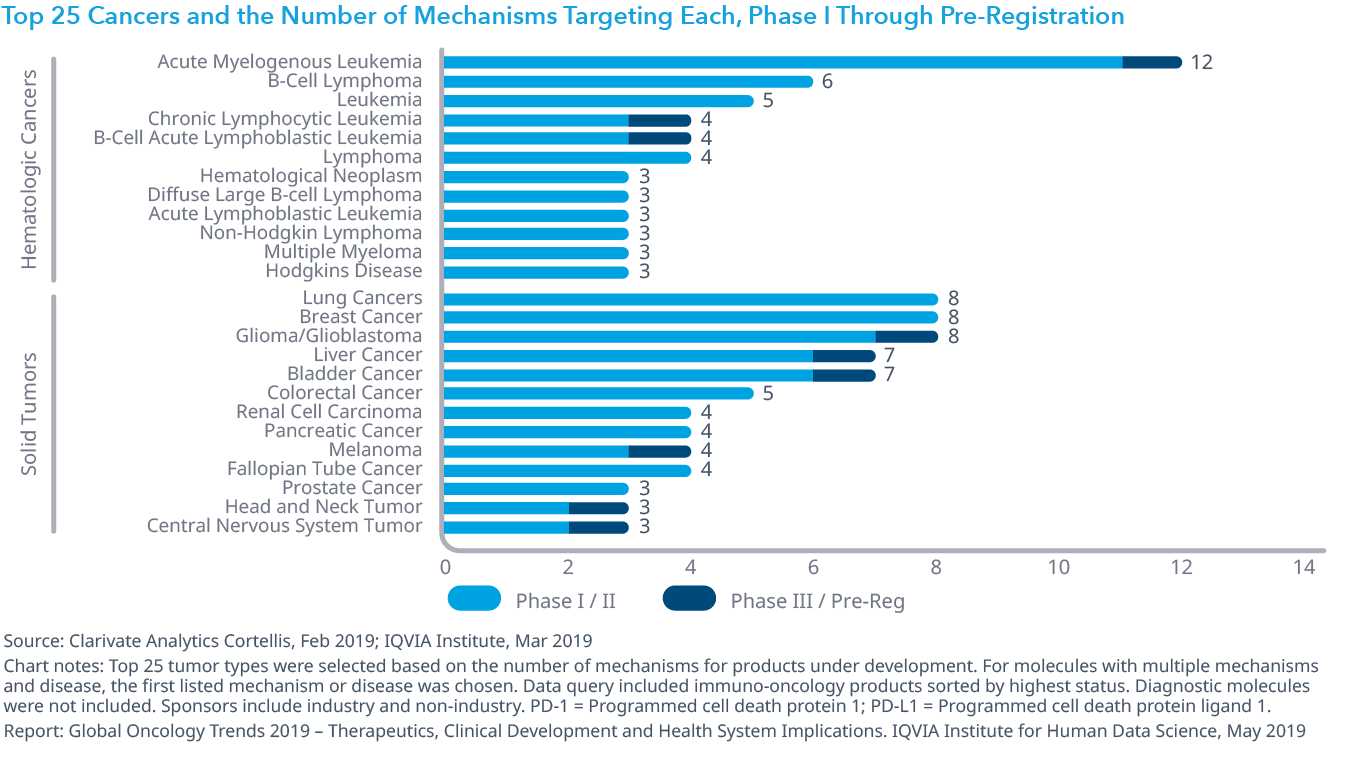
Chart 13: Company Late-Stage Pipelines, Number of Oncology Indications and Oncology Percent of Pipeline
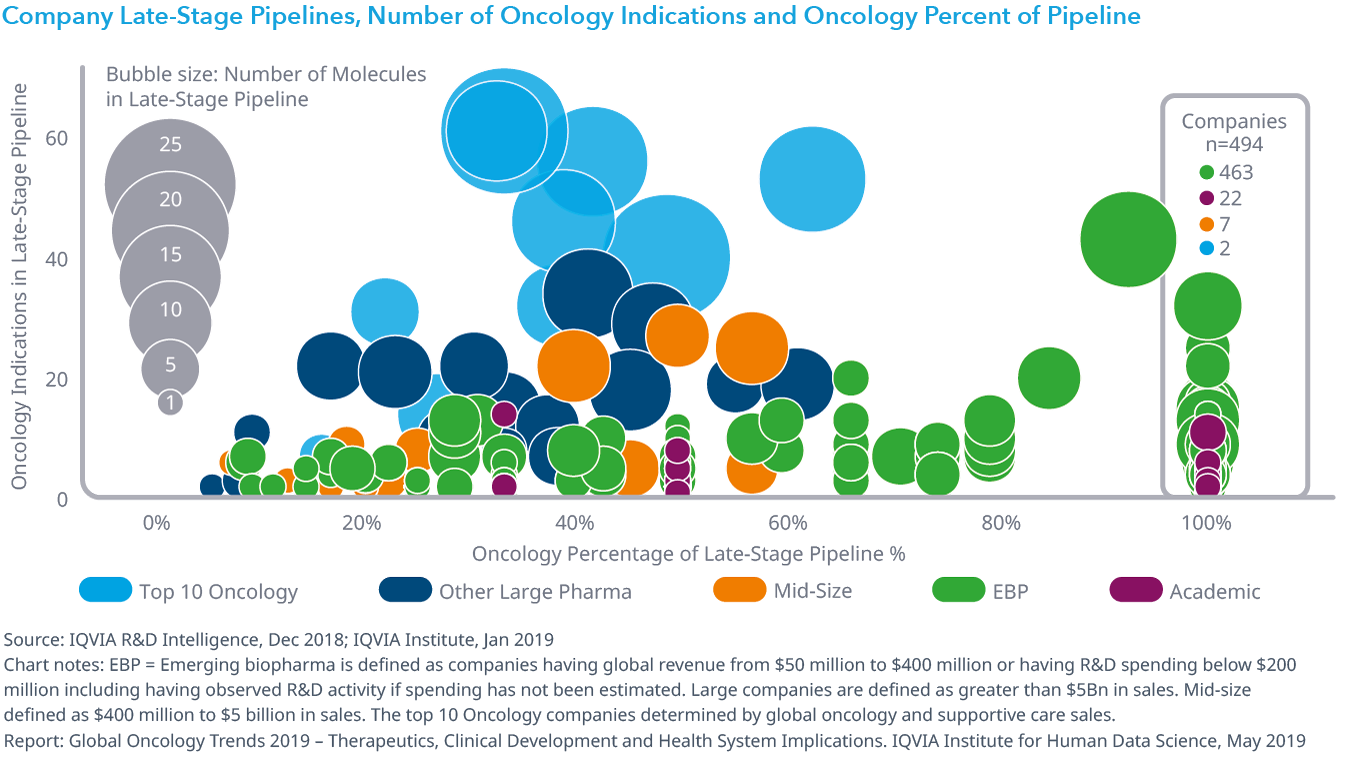
Chart 14: Number of Oncology Clinical Trials and by Phase, 2010–2018
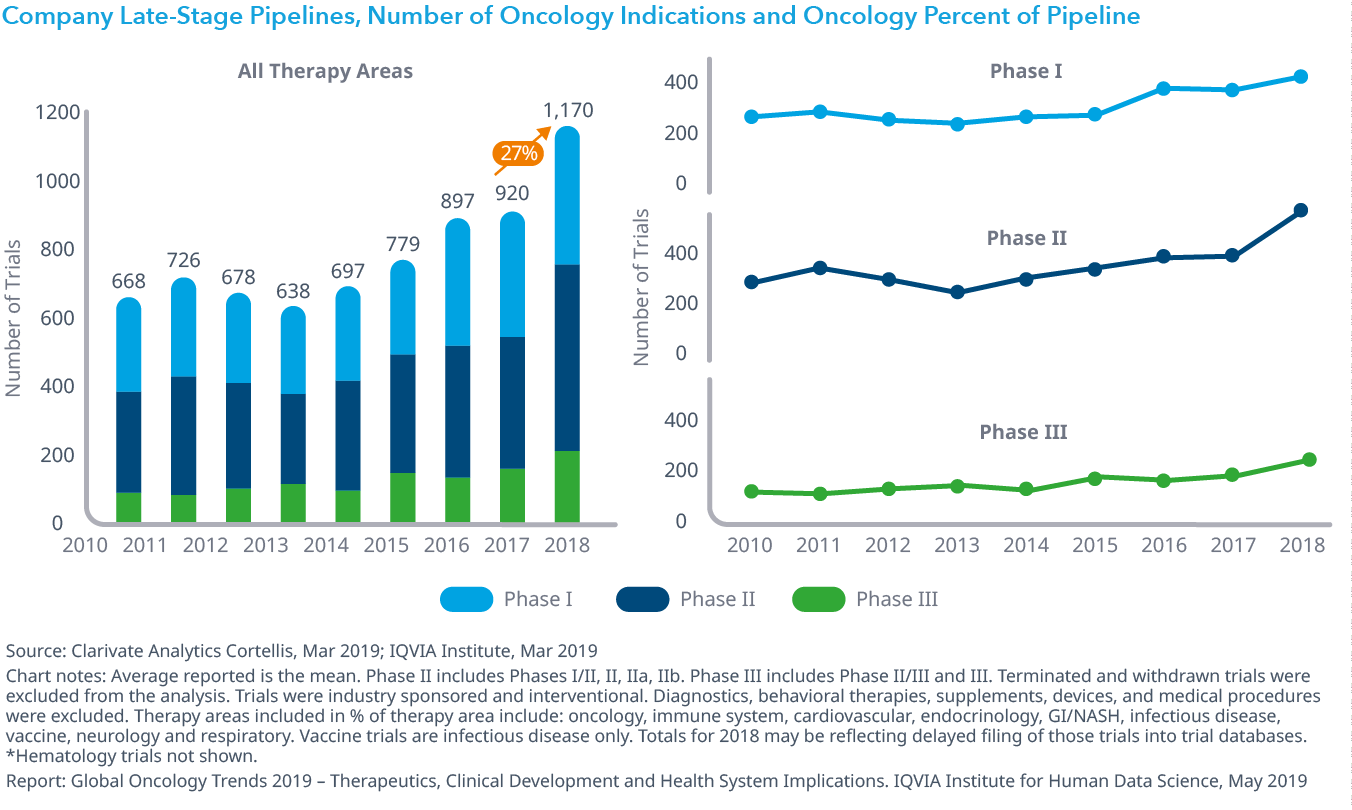
Chart 15: Oncology Trial Phase Transition Success Rate by Phase, 2010–2018
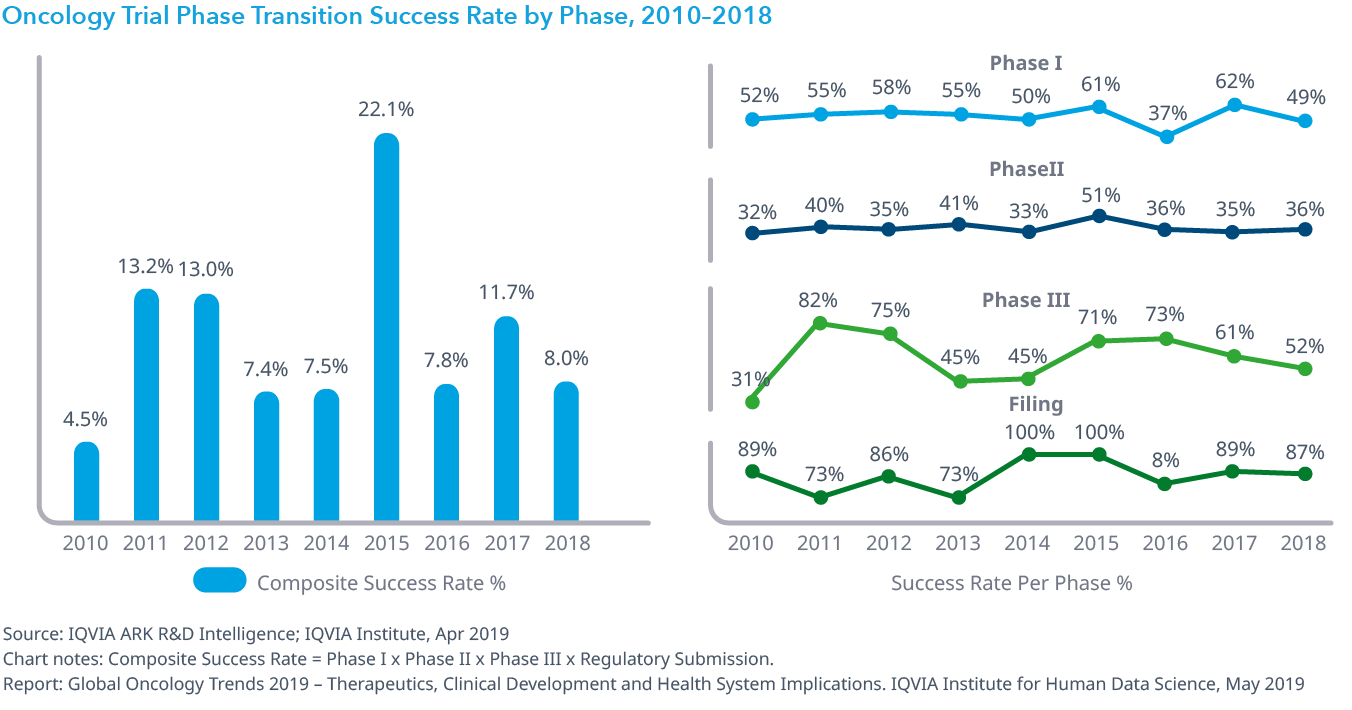
Chart 16: Mean Trial Duration, 2010–2018
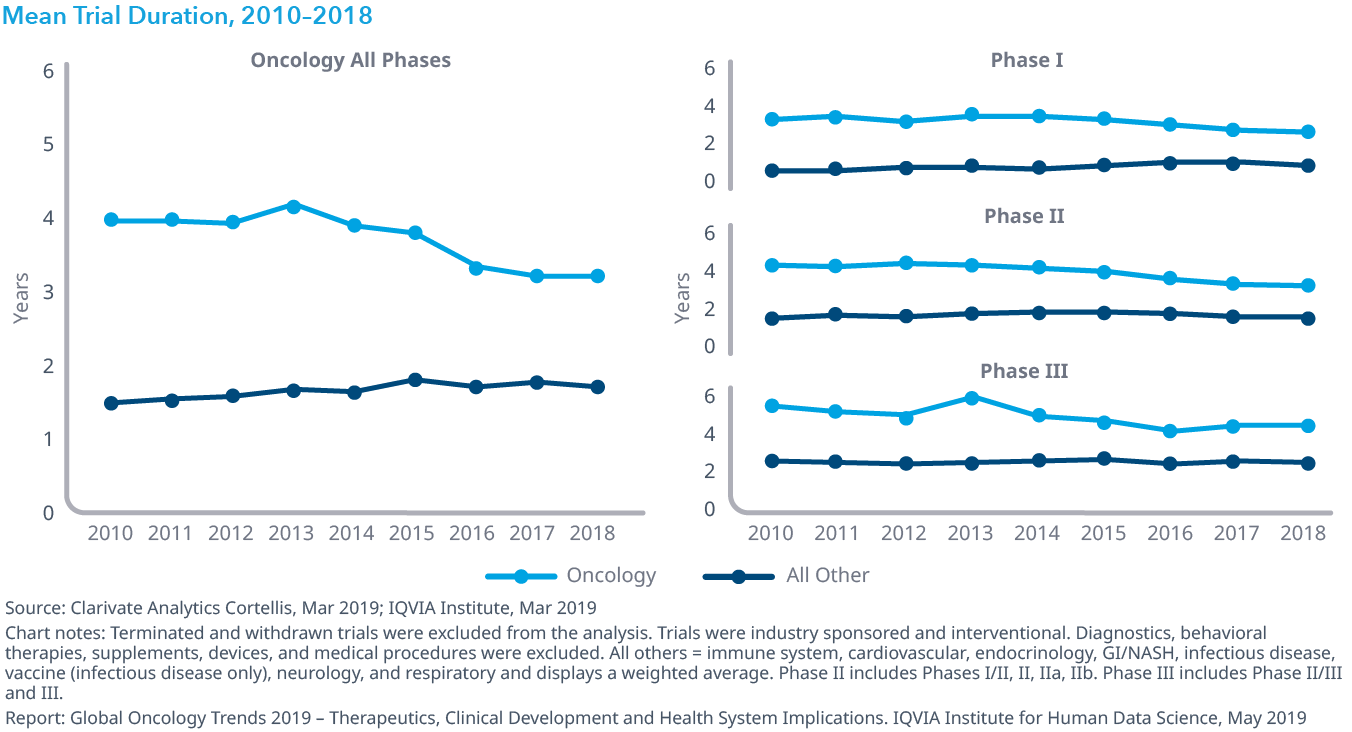
Chart 17: Trial Complexity, 2010–2018
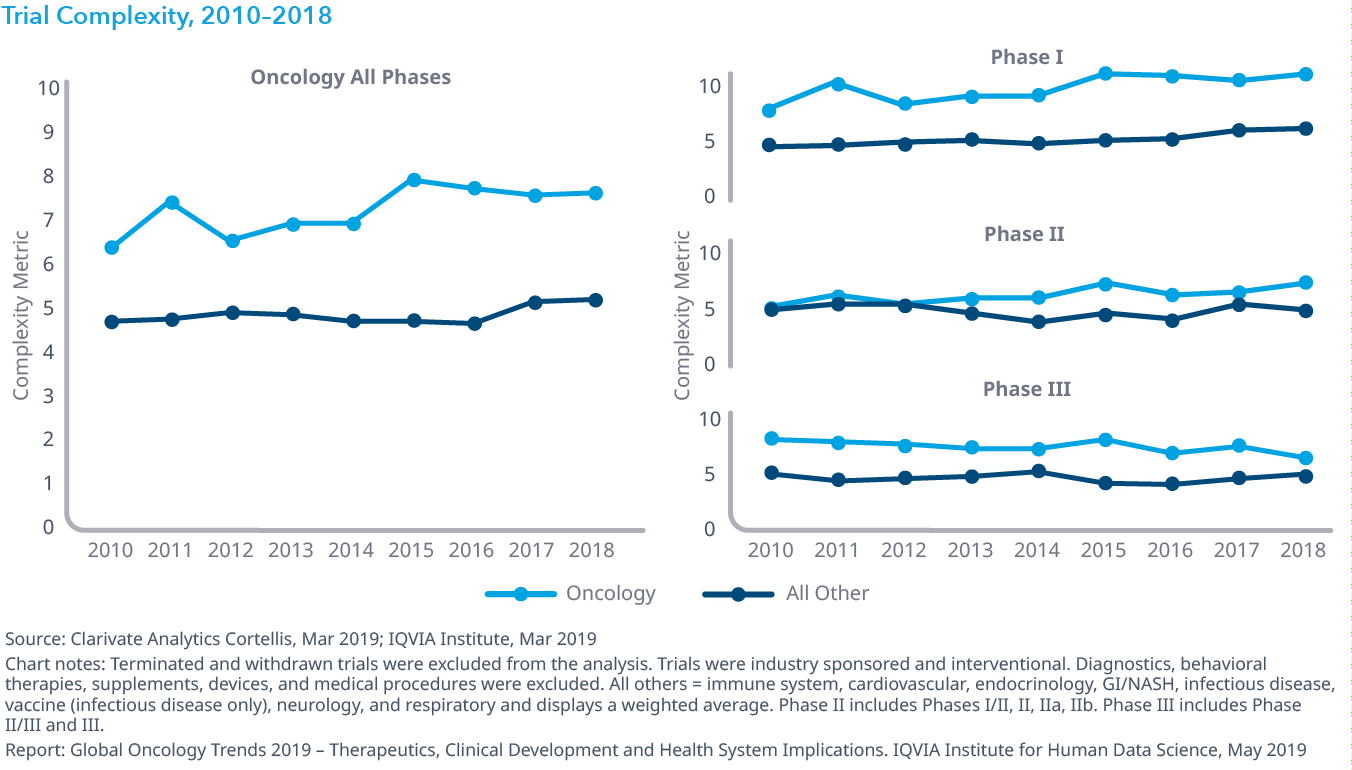
Chart 18: Trial Productivity, 2010 –2018
Chart 19: Average Number of Indications per Phase of Development, 2010–2018
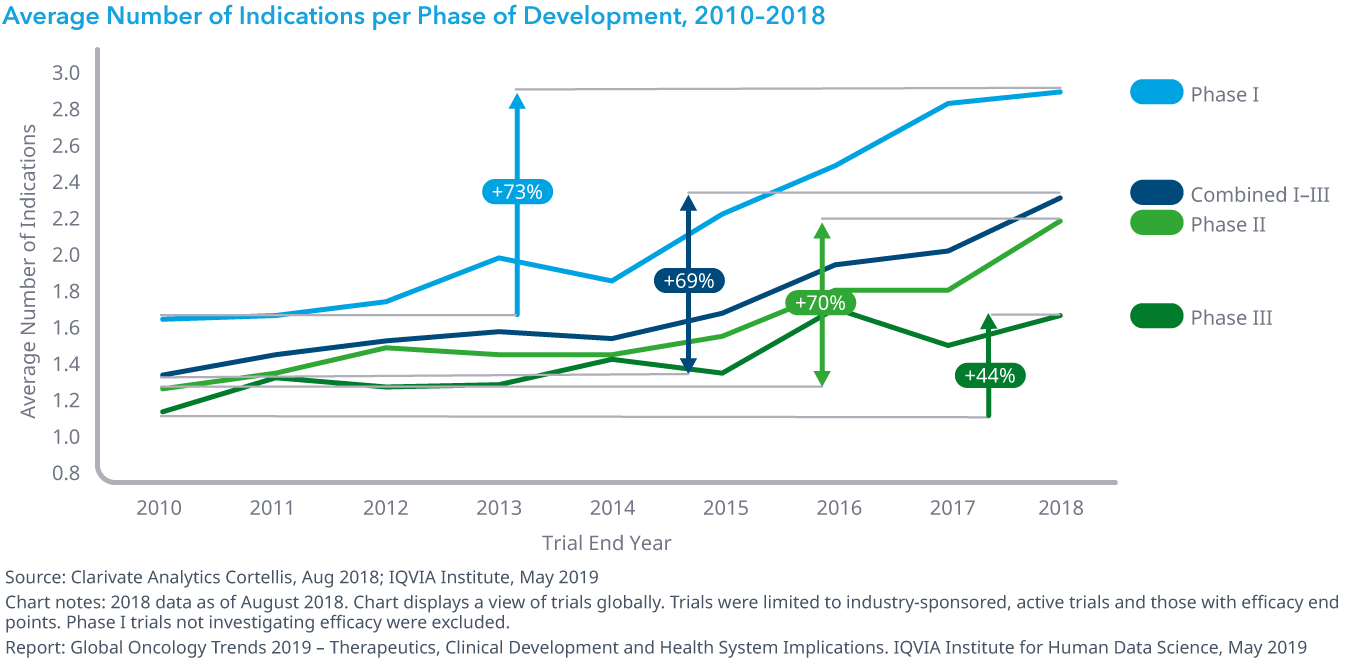
Chart 20: Number and Percentage of Oncology Phase I–III Trials by Biomarker Type, 2010–2018
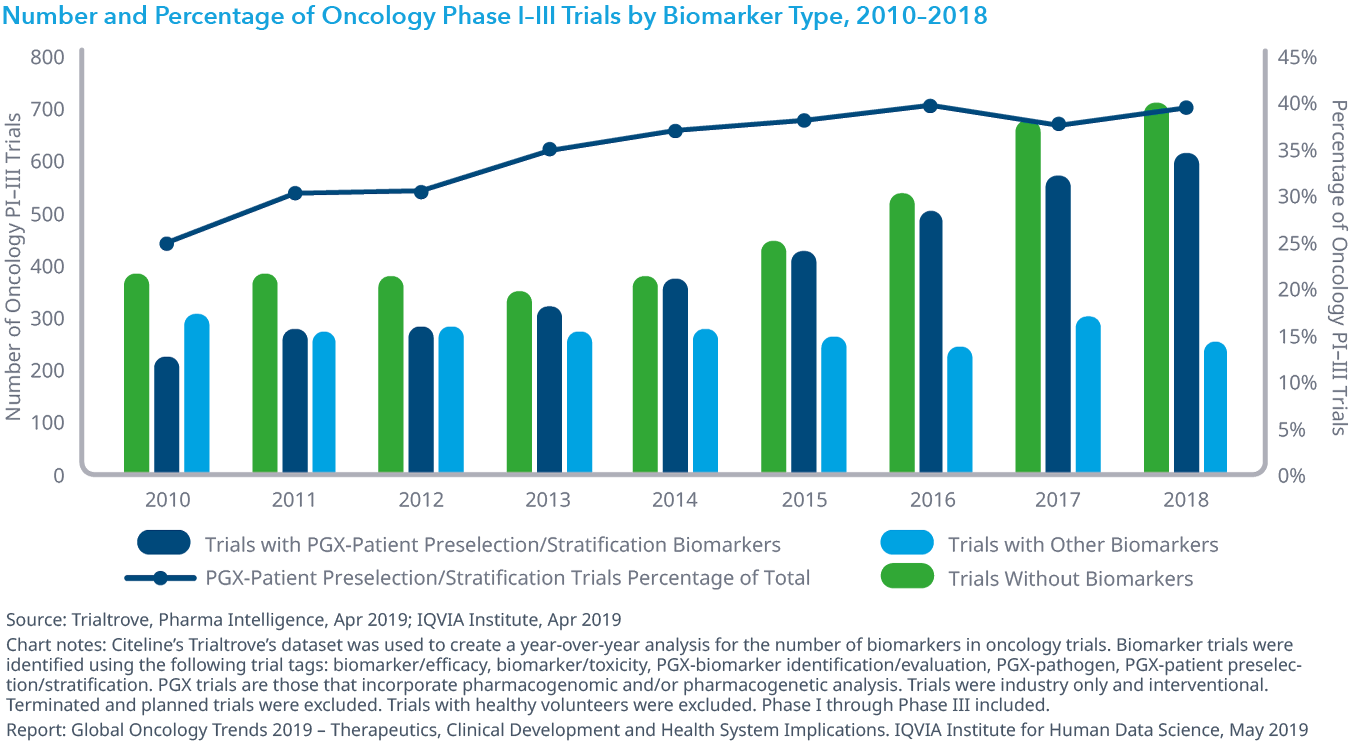
Chart 21: Trends Driving Change in Oncology Clinical Development
Chart 22: Predicted Percentage Change in Productivity per Trend in Oncology from 2018 to 2023
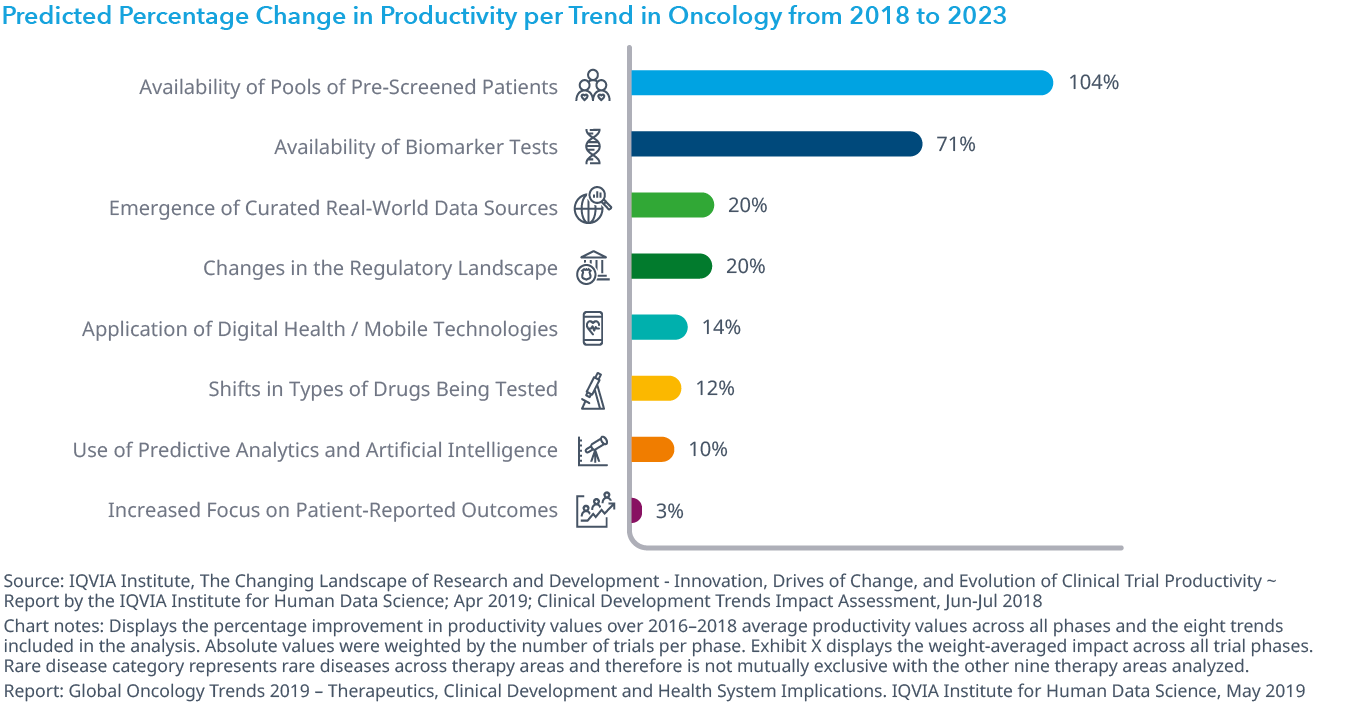
Chart 23: Median Time from First Patent Filing to Launch by NAS Launch Year, United States
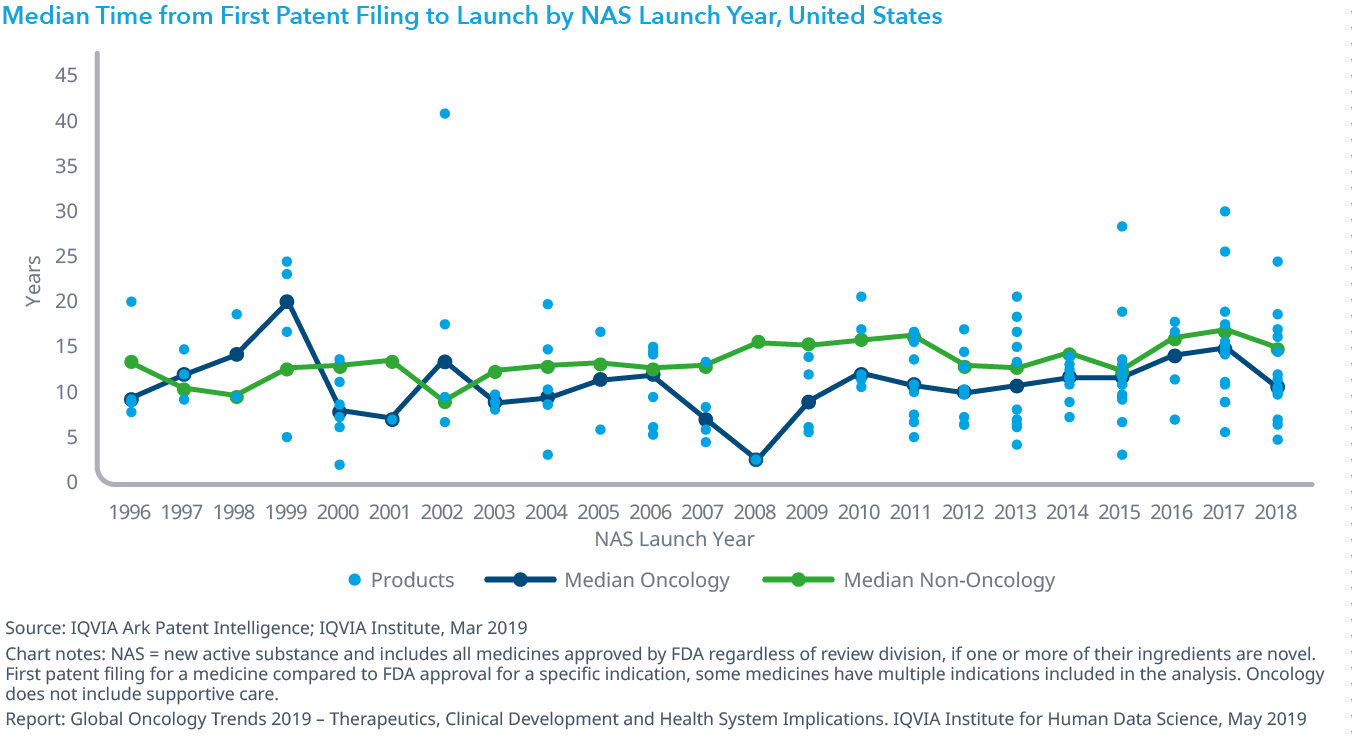
Chart 24: Availability in 2018 of Oncology Medicines Launched in 2013–2017
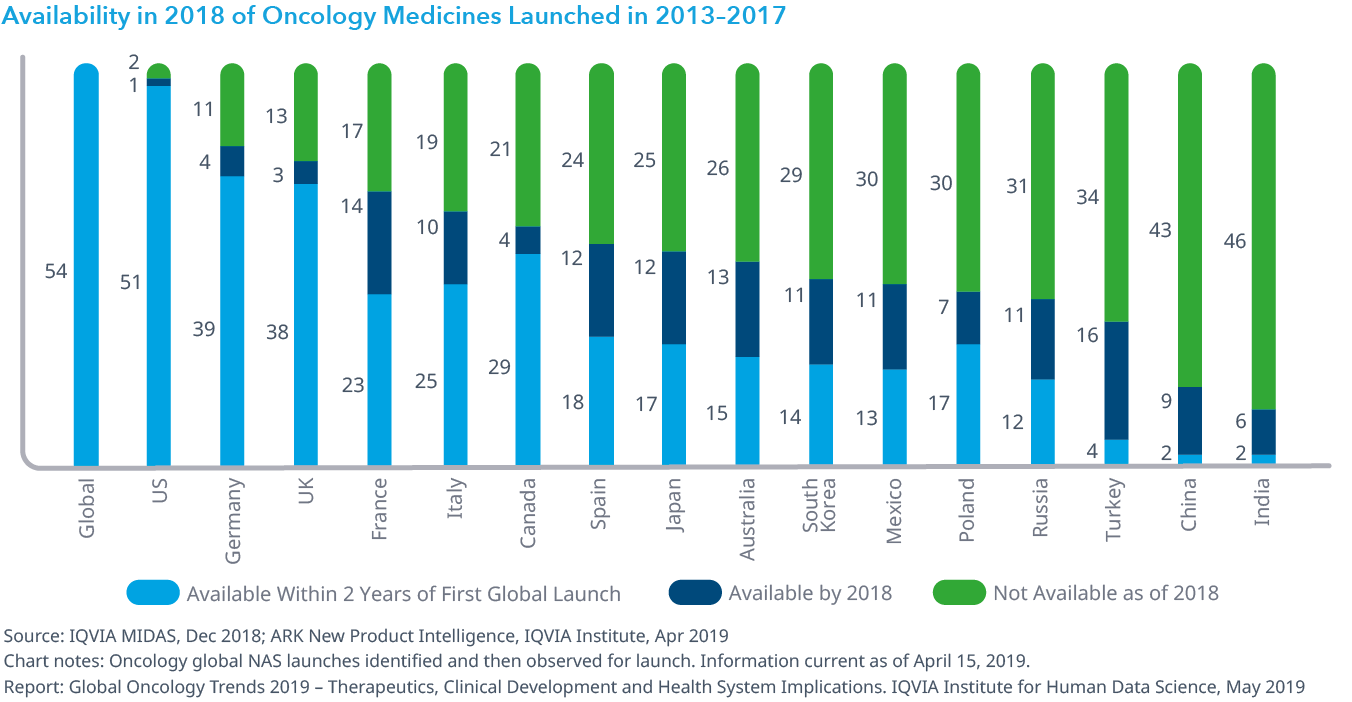
Chart 25: Percentage of United States and EU5 Patients Tested for Biomarker by Cancer Type
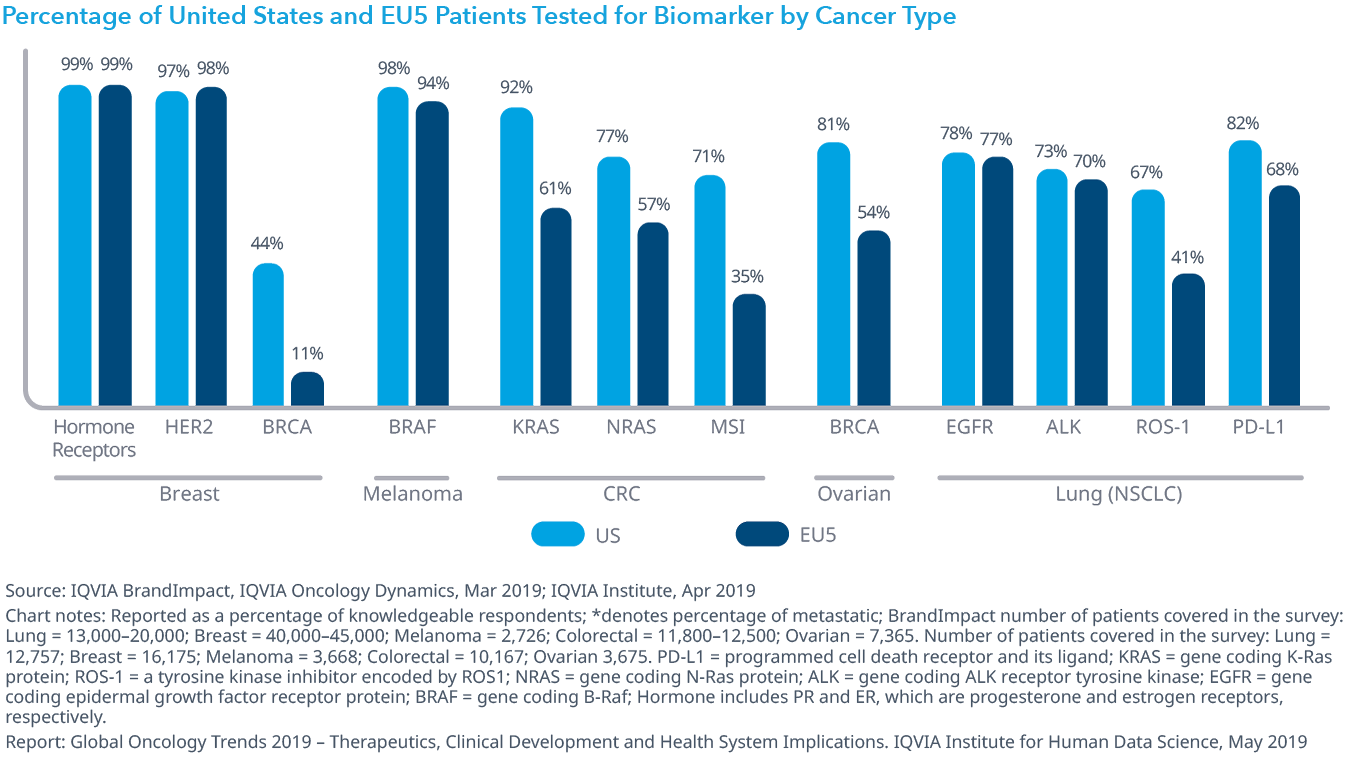
Chart 26: Percentage of Patients Tested by Biomarker and Cancer in Europe and Patients Receiving Drug Targeting Once Tested Positive
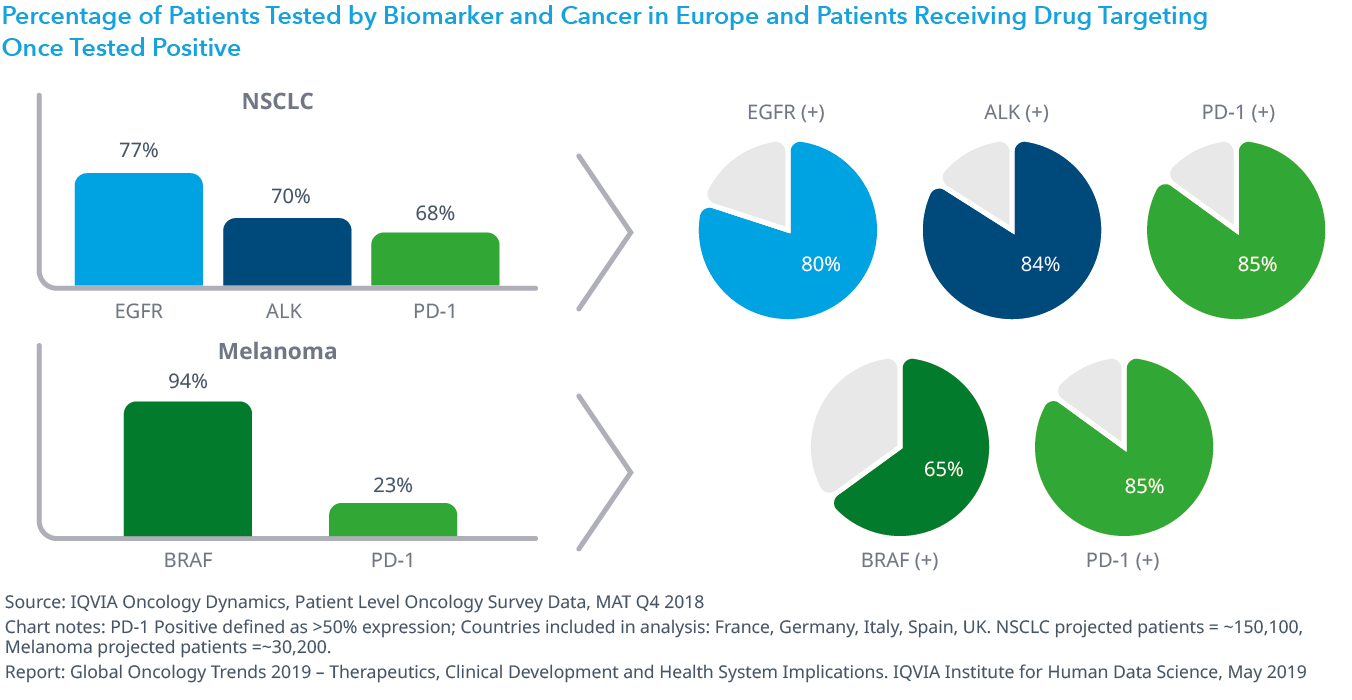
Chart 27: United States CAR-T Centers and Number of Centers in France Achieving Administration Eligibility Requirements and Percentage of NHL Patients Able to Be Treated by Those Centers
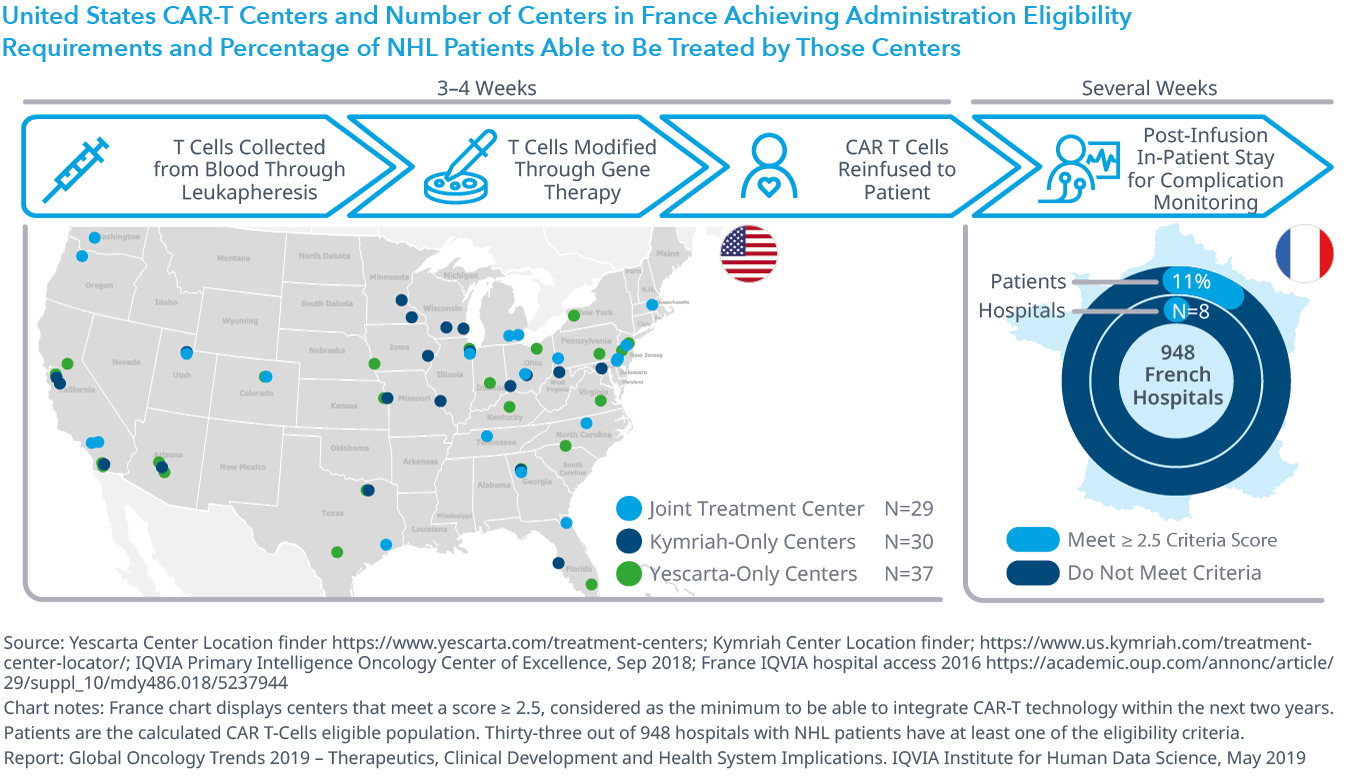
Chart 28: Five-Year Trend of Health Technology Assessments and Their Outcomes in Oncology for EU3
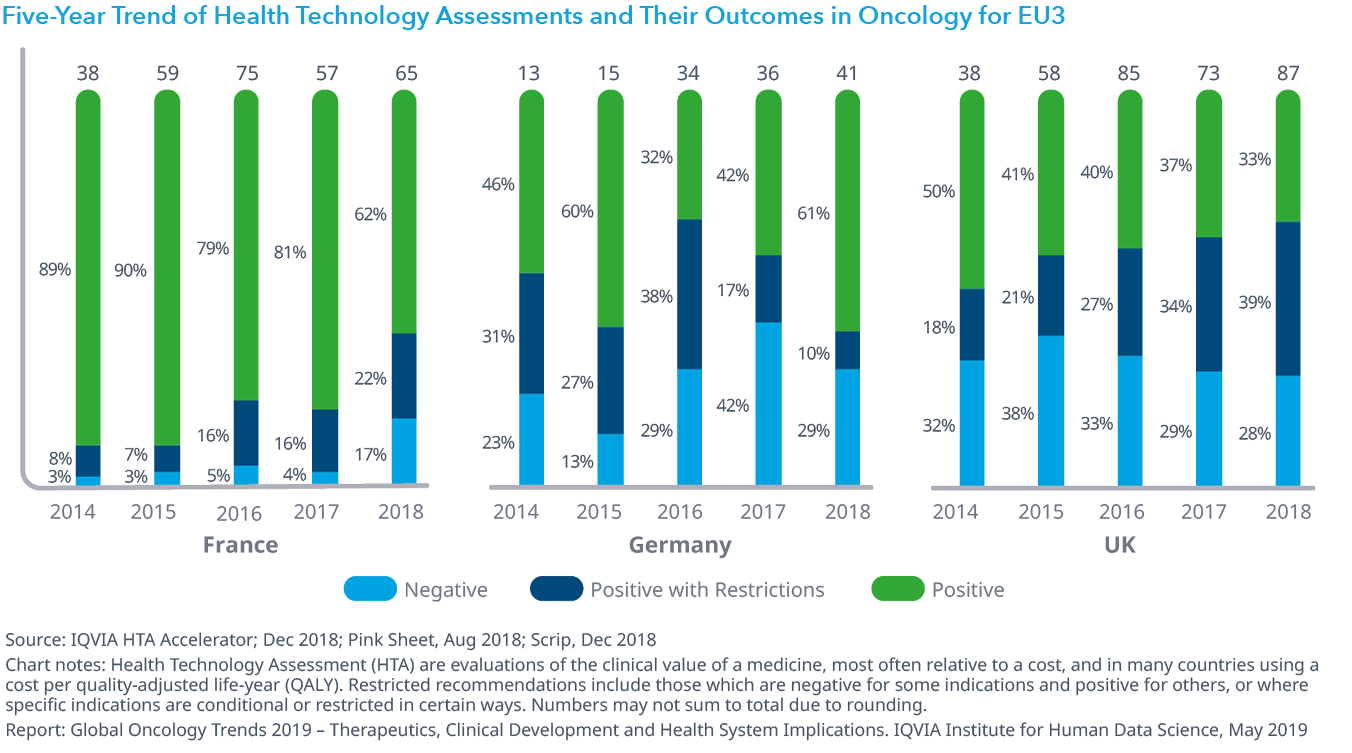
Chart 29: Total Spending on Oncology Medicine and Supportive Care and Growth US$Bn
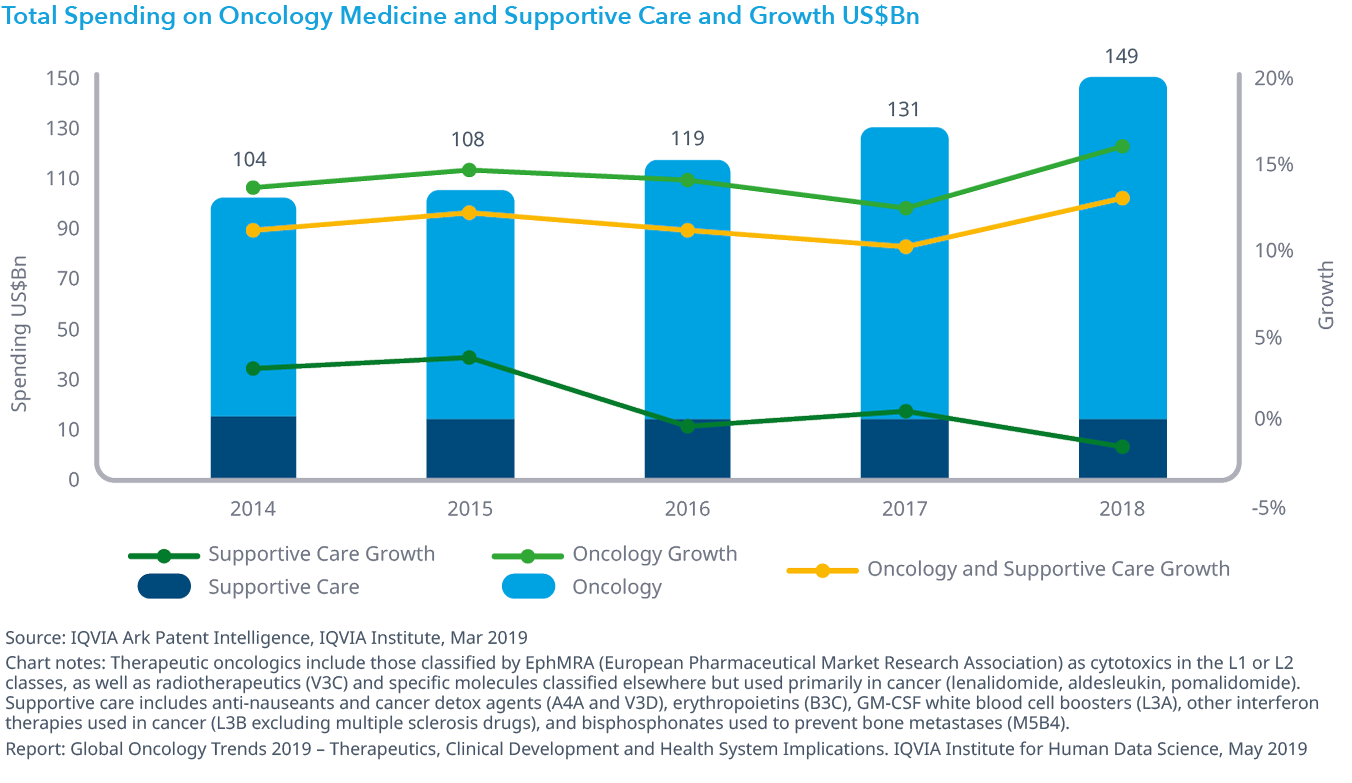
Chart 30: Oncology Therapeutic Spending Growth by Product Segment, 2014–2018
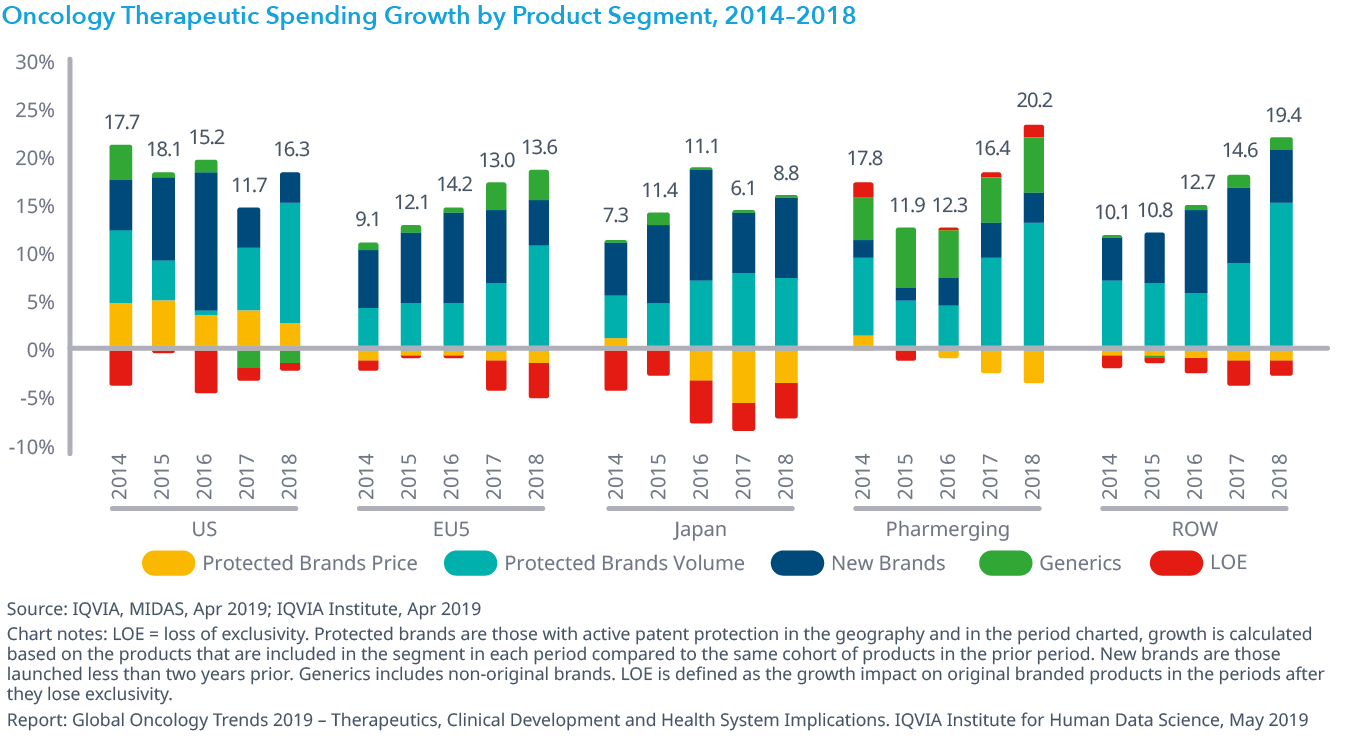
Chart 31: United States Oncology Therapeutic Market Spending and Growth by Segment, Const US$Bn
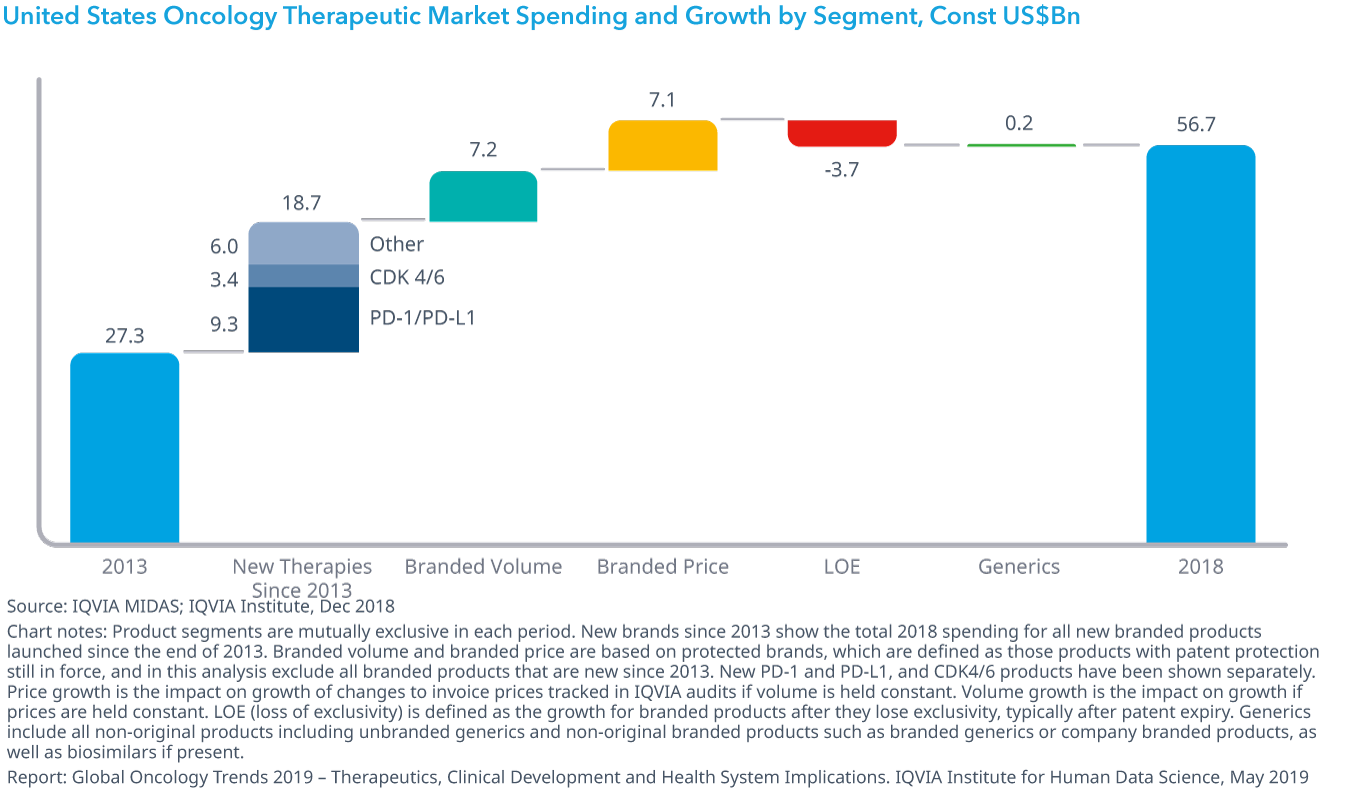
Chart 32: Oncology Therapeutic Market Spending and Growth by Segment Outside the United States, Constant US$Bn
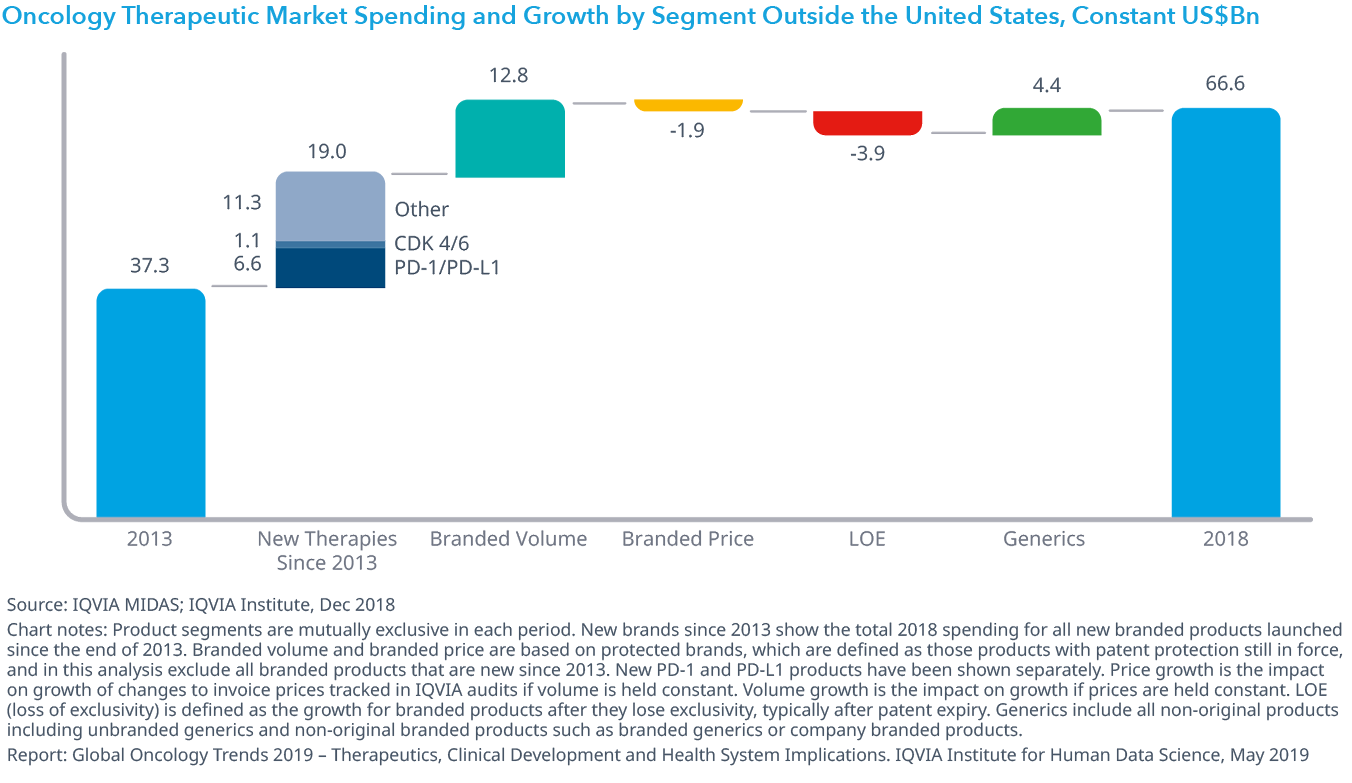
Chart 33: Average Annual Costs for Oncology Products by Launch Year in the United States
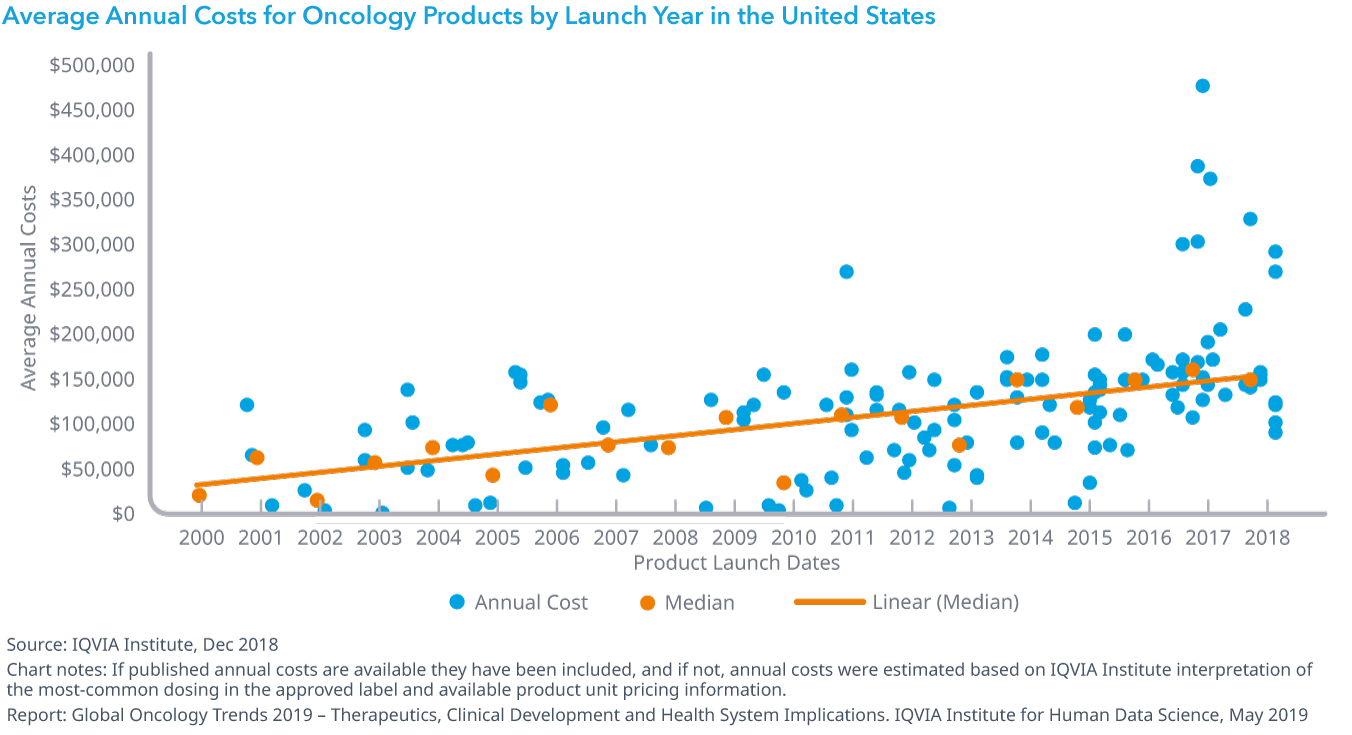
Chart 34: Global Markets Number of Oncologic Medicines Available and Average Spending per Product
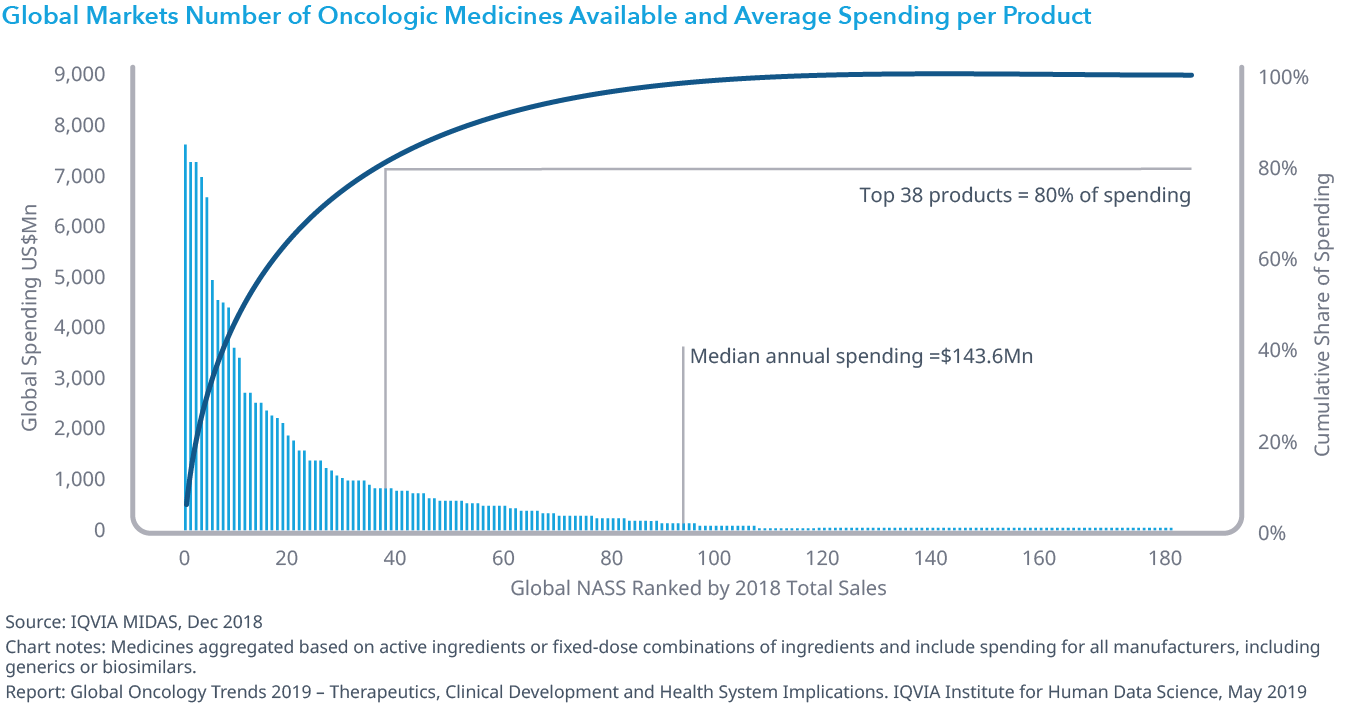
Chart 35: Total Spending on Medicines and Growth in China, US$Bn
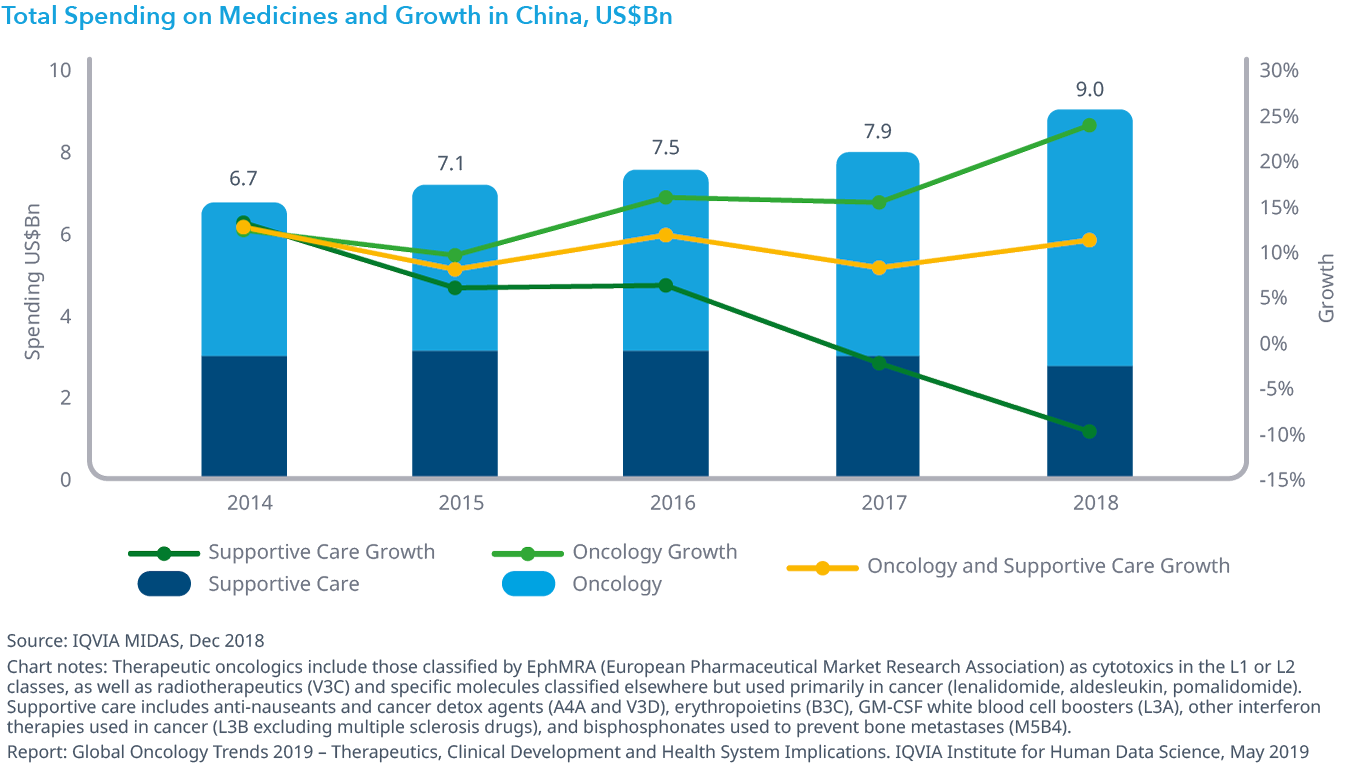
Chart 36: Oncology Therapeutic Market Spending and Growth by Segment in China, Constant US$Bn
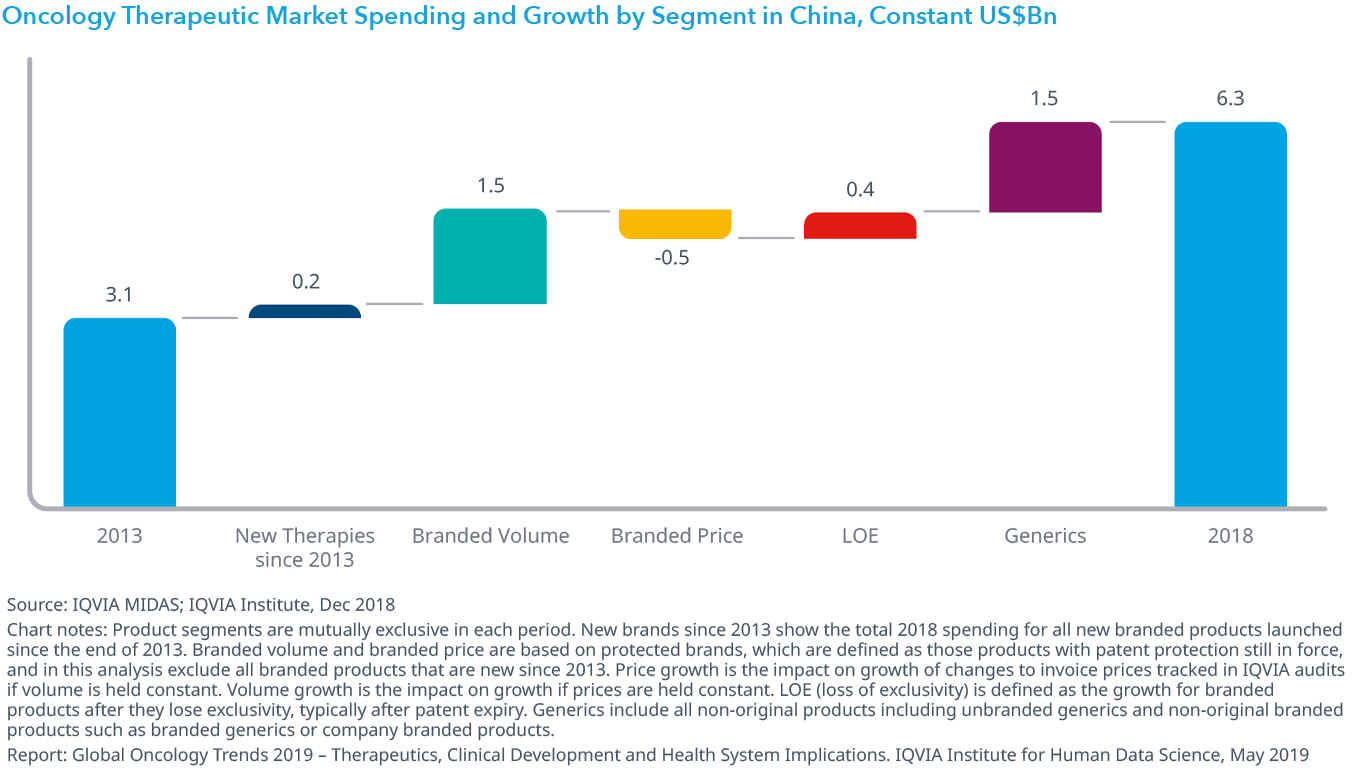
Chart 37: Progress in Approving Novel Compounds is Improving in China
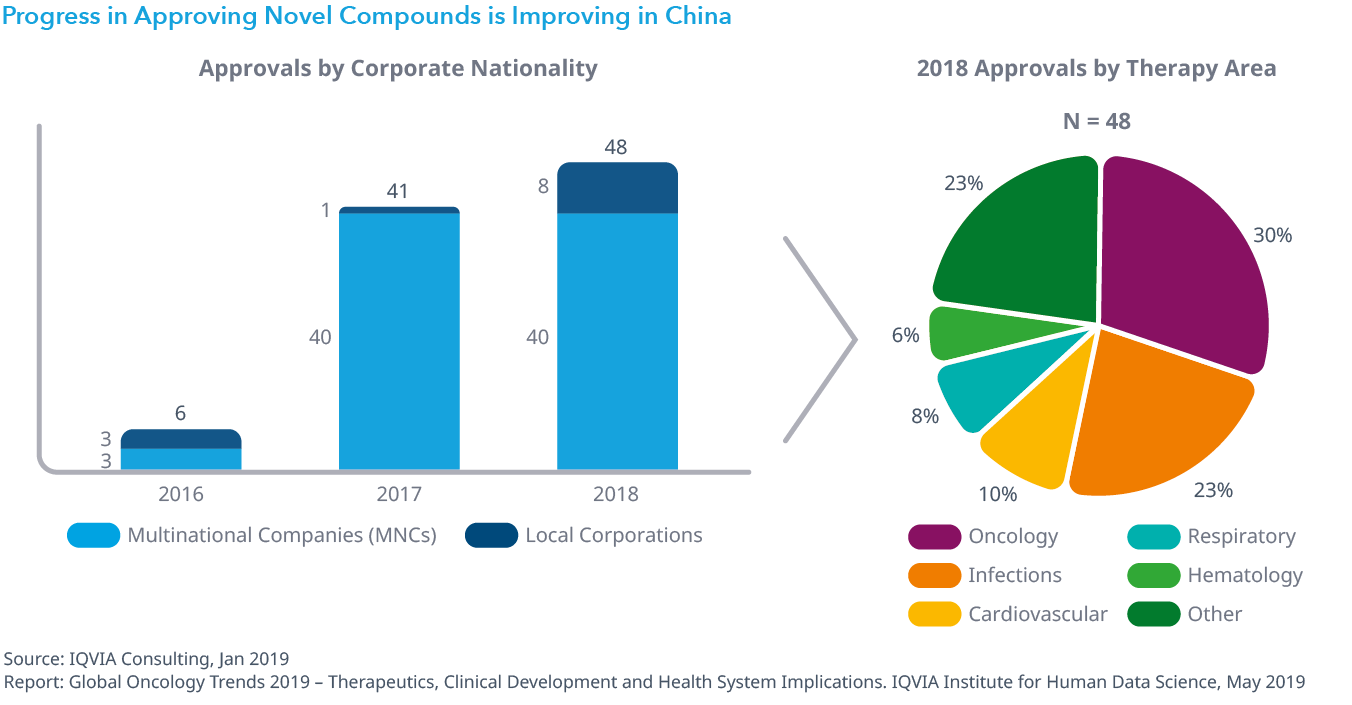
Chart 38: Total Spending on Oncology Medicines and Supportive Care and Growth US$Bn
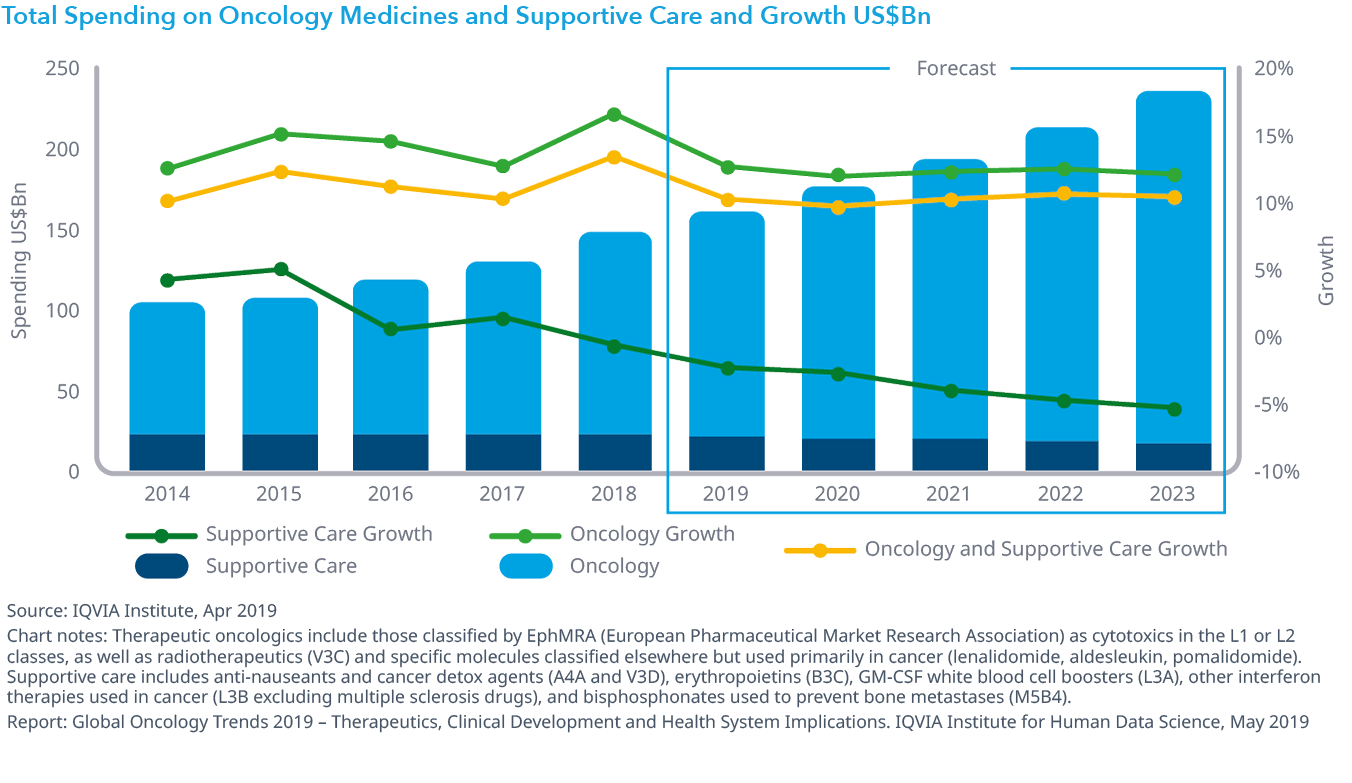
Chart 39: Growth Rates for Global Oncology Therapeutic Medicines, Constant US$, 2014–2023